Biomarkörer i klinisk praxis
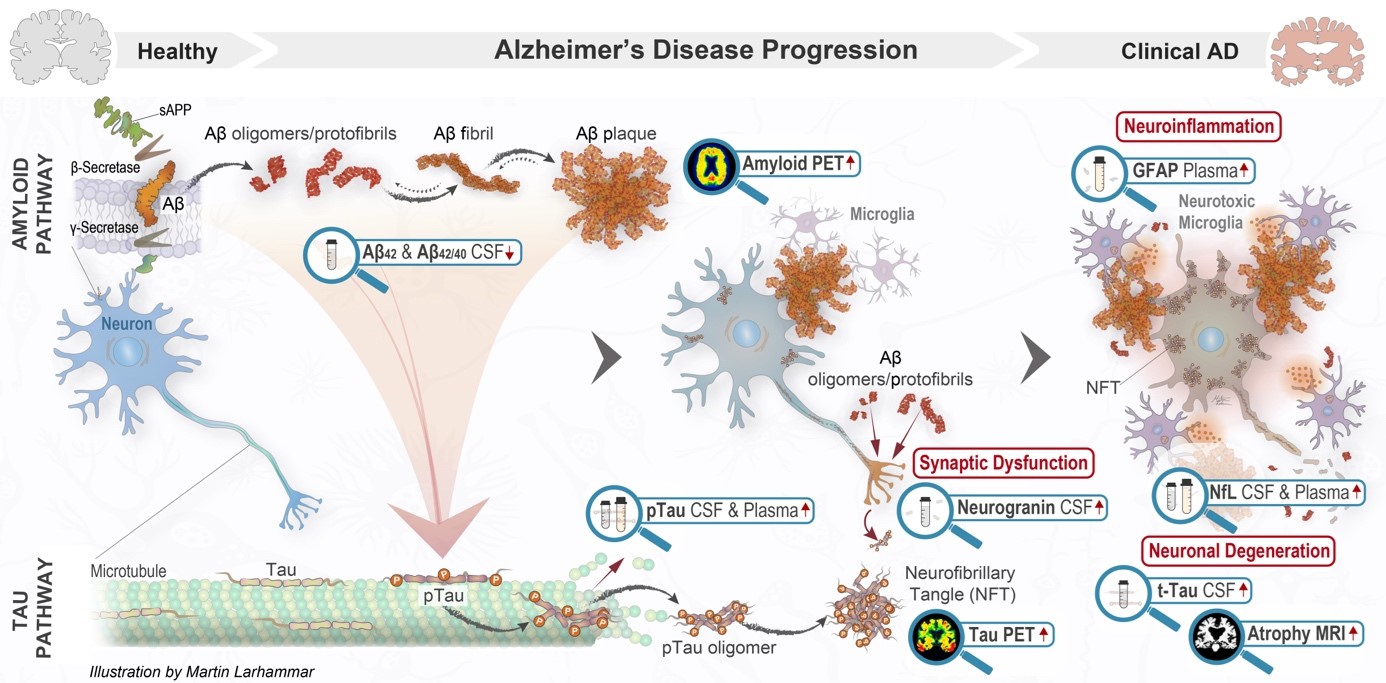
Fig 1 Referenser: 1. Jack et al. Revised criteria for diagnosis and staging of Alzheimer’s disease: Alzheimer’s Association Workgroup, Alzheimers Dement 2024 2. Hansson O, Biomarkers for neurodegenerative diseases, Nat Med. 2021
Likvorbaserade biomarkörer
De mest tillgängliga och använda biomarkörerna i Norden för Alzheimers sjukdom (AD) är de som mäts i likvor. Ett vanligt så kallat ”AD-paket” av prover inkluderar Aβ42, Aβ40, fosforylerat tau (P-tau) och total-tau (T-tau). På grund av den starka korrelationen mellan P-tau och T-tau vid AD är det sällan relevant att tolka T-tau separat, med undantag för vissa specialfall, som vid misstänkt Creutzfeldt-Jacobs sjukdom.1
Eftersom det finns likvordynamiska variationer mellan patienter bör dessa biomarkörer inte tolkas enskilt, utan helst som ett ratio, exempelvis Aβ42/40 eller Aβ42/P-tau. Det är inte ovanligt att samtliga markörer är sänkta eller stegrade utan någon bakomliggande patologisk process.1 Ett till synes normalt Aβ42 eller P-tau värde, i kombination med ett tydligt avvikande ratio, bör därför tolkas som förekomst av AD-patologi. Dessa markörer räknas till så kallade Core 1-biomarkörer (Fig.2) och kan främst användas för att avgöra om AD-förändringar föreligger eller inte. Core 2-biomarkörer (Fig.2) är markörer som kan ge en bild av vilket patofysiologiskt (biologiskt) stadium sjukdomen befinner sig i. Dessa biomarkörer är dock ännu bara tillgängliga inom ramen för forskningsstudier.1
Neurofilament (NfL) mäts ofta vid kognitiva utredningar, men har begränsat värde i utredningen av AD. NfL kan på gruppnivå visa hur aktiv den neurodegenerativa processen är, men är normalt hos ungefär hälften av alla patienter med AD. Markören är i stället differentialdiagnostiskt viktigare vid misstanke om frontotemporallobssjukdomar och atypisk Parkinson, och är ofta stegrat vid vaskulär genes till den kognitiva svikten.1-3
T-tau = Total-tau
P-tau = Fosforylerat tau
NfL = Neurofilament
MCI = Lindrig kognitiv svikt
Non-p-tau = Icke-fosforylerat tau
Vem ska testas med biomarkörer?
Enligt internationella riktlinjer rekommenderas biomarkörstestning främst vid lindrig kognitiv svikt (MCI) eller demens, och inte vid normala kognitiva testresultat. Detta beror framför allt på att man idag saknar evidens för den kliniska relevansen av ett eventuellt positivt resultat i detta tidiga stadie. I vissa selekterade fall kan testning ändå vara motiverad – till exempel när det finns tydliga kliniska misstankar och subjektiva symtom trots normala resultat på kognitiva tester. I sådana fall är det viktigt att patienten får noggrann information om testets innebörd och möjliga konsekvenser.4 Innan testning bör man ha kartlagt de kognitiva symptomen för att bilda sig en uppfattning om sannolikheten att det rör sig om AD. Denna så kallade pre-test sannolikhet påverkar hur testresultat kan tolkas.
Att tolka testresultat utifrån pre-test sannolikhet
Vid hög pre-test sannolikhet, till exempel ett typiskt AD-syndrom hos äldre person, kan man med stor säkerhet lita på ett positivt resultat (högt positivt prediktivt värde). Däremot bör ett negativt resultat tolkas med viss försiktighet eftersom det i detta sammanhang har ett lägre negativt prediktivt värde. Det omvända gäller vid låg pre-test sannolikhet, till exempel om patienten endast har subjektiva besvär eller kliniskt syndrom som inte stämmer med AD.
Ibland ifrågasätts om äldre personer (över 80 år) ska testas med AD biomarkörer. Även hos denna åldersgrupp är biomarkörerna generellt lika tillförlitliga för att påvisa AD-patologi. Eftersom det i denna ålder är vanligt med både icke-symtomgivande AD-patologi och andra hjärnskador som kan orsaka kognitiv svikt, blir ett positivt testresultat svårare att tolka. Ett negativt test kan däremot användas för att utesluta AD.5
Blodbaserade biomarkörer för AD
De senaste åren har blodbaserade biomarkörer snabbt utvecklats och visar nu lovande resultat i valideringsstudier.6,7 Den mest etablerade är plasma p-tau217 som visat likvärdiga resultat jämfört med likvormarkörer. Denna har nu börjat bli tillgänglig i klinisk rutin världen över, antingen som enskild biomarkör eller som ett ratio till Aβ42 eller icke-fosforylerat tau (non-p-tau). I nuläget rekommenderas den endast att användas på specialiserade kliniker för kognitiva sjukdomar, men kommer framöver sannolikt att kunna vara ett viktigt verktyg i utredningen redan på primärvårdsnivå.
| BIOMARKER CATEGORY | CSF or plasma analytes | Imaging |
|---|---|---|
| Core biomarkers | ||
| Core 1 | ||
| A (Aβ proteinopathy) | Aβ 42 | Amyloid PET |
| T1: (phosphorylated and secreted AD tau) | p-tau217, p-tau181, p-tau231 | |
| Core 2 | ||
| T2: (AD tau proteinopathy) |
MTBR-tau243, other phosphorylated tau forms (e.g., p-tau205), non-phosphorylated mid-region tau fragmentsa |
Tau PET |
| Biomarkers of non-specific processes involved in AD pathophysiology | ||
| N (injury, dysfunction, or degeneration of neuropil) | NfL | Anatomic MRI, FDG PET |
| I (inflammation) Astrocytic activation |
GFAP | |
| Biomarkers of non-AD copathology | ||
| V (vascular brain injury) | Infarction on MRI or CT, WMH | |
| S (α-synuclein) | αSyn-SAAa | |
Fig 2. Bearbetad från: Jack, C. R., Jr. et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement 20, 5143-5169 (2024).
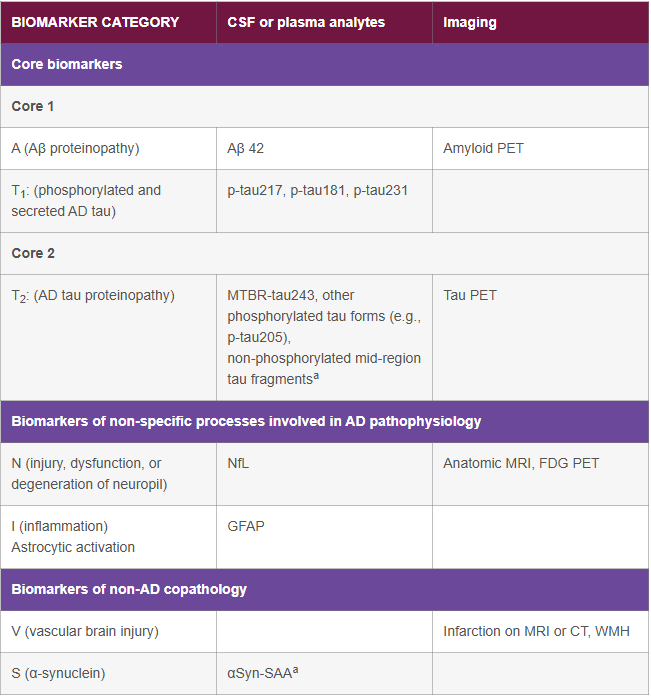
Fig 2.
Referenser
1. Jack CR, et al. Revised criteria for diagnosis and staging of Alzheimer’s disease: Alzheimer’s Association Workgroup. Alzheimers Dement. 2024;20(8):5143-69. doi:10.1002/alz.13859.
2. Olsson B, et al. CSF and blood biomarkers for the diagnosis of Alzheimer’s disease: a systematic review and meta-analysis. Lancet Neurol. 2016;15(7):673-84. doi:10.1016/S1474-4422(16)00070-3.
3. Ashton NJ, et al. A multicentre validation study of the diagnostic value of plasma neurofilament light. Nat Commun. 2021;12(1):3400. doi:10.1038/s41467-021-23620-z.
4. Shaw LM, et al. Appropriate use criteria for lumbar puncture and cerebrospinal fluid testing in the diagnosis of Alzheimer’s disease. Alzheimers Dement. 2018;14(11):1505-21. doi:10.1016/j.jalz.2018.07.220:
5. Jansen WJ, et al. Prevalence of cerebral amyloid pathology in persons without dementia: a meta-analysis. 2015;313(19):1924-38. doi:10.1001/jama.2015.4668.
6. Palmqvist S, et al. Blood biomarkers to detect Alzheimer disease in primary care and secondary care. 2024;332(15):1245-57. doi:10.1001/jama.2024.13855.
7. Palmqvist S, et al. Plasma phospho-tau217 for Alzheimer’s disease diagnosis in primary and secondary care using a fully automated platform. Nat Med. 2025;31(6):2036-43. doi:10.1038/s41591-025-03622-w.