Effekten av LEQEMBI® (lecanemab) ökar över tid 1,2
Skillnaden i vunnen tid i ett mildare och mer oberoende stadium av sjukdomen mellan patienter som får fortsatt behandling med LEQEMBI jämfört med obehandlade* patienter ökar kumulativt över 4 år (CDR-SB)3
*Patienterna har inte behandlats med anti-amyloid antikroppsbehandling
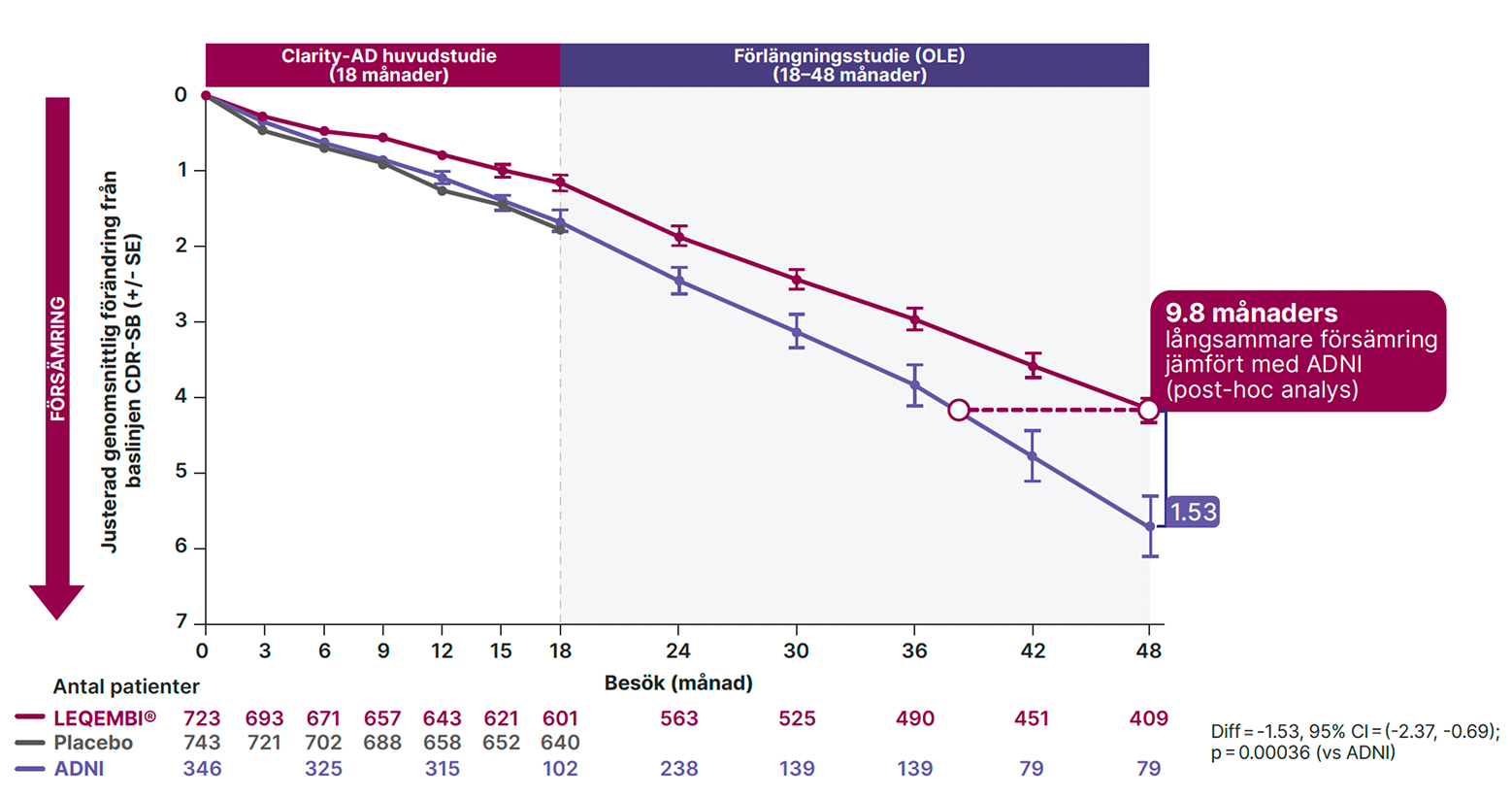
Figur 1. Justerad medelförändring (± SD) från baslinjen mätt med CDR-SB – CLARITY-AD huvudstudie och förlängningsstudie – jämfört med kohorterna i ADNI vid 4 år2,3
Hos de patienter (n=409) som fick kontinuerlig behandling med lecanemab under 48 månader i förlängningsstudien (OLE-studien, open label extension) av registreringsstudien för LEQEMBI, Clarity-AD**, sågs en långsammare försämring av kognitiva symptom och funktion med en skillnad på 1.53 på CDR-SB-skalan (95% KI = -2.37, -0.69; p=0.00036) jämfört med den försämring som observerades i en obehandlad matchad grupp patienter från ADNI kohorten (Alzheimer’s Disease Neuroimaging).3,4 ADNI-kohorten hade en liknande grad av försämring som placebogruppen vid 18 månader, vilket indikerar matchade patientpopulationer.3
**Clarity-AD är en pivotal, global 18-månaders randomiserad studie (RCT) av LEQEMBI-behandling vid tidig Alzheimers sjukdom.1,2 Denna huvudstudie följs av en förlängningsstudie (OLE) med total behandlingsdata på 4 år.3
Läs mer här om syftet och studiedesignen av förlängningsstudien.
Syftet med förlängningsstudien var att utvärdera den långsiktiga säkerheten och tolerabiliteten av LEQEMBI. Ytterligare ett viktigt syfte var att utvärdera långsiktiga effekter av LEQEMBI, ifall de effekter mätt med kliniska utfallsmått och biomarkörer som nåtts vid slutet av CLARITY AD huvudstudie bibehölls över tid.
De patienter som deltog i huvudstudien fick möjligheten att fortsätta i en öppen förlängningsfas (OLE) där de patienter som i huvudstudien randomiserats till LEQEMBI fick möjlighet att fortsätta behandlingen och de patienter som randomiserats till placebo fick möjlighet att påbörja behandling med LEQEMBI.
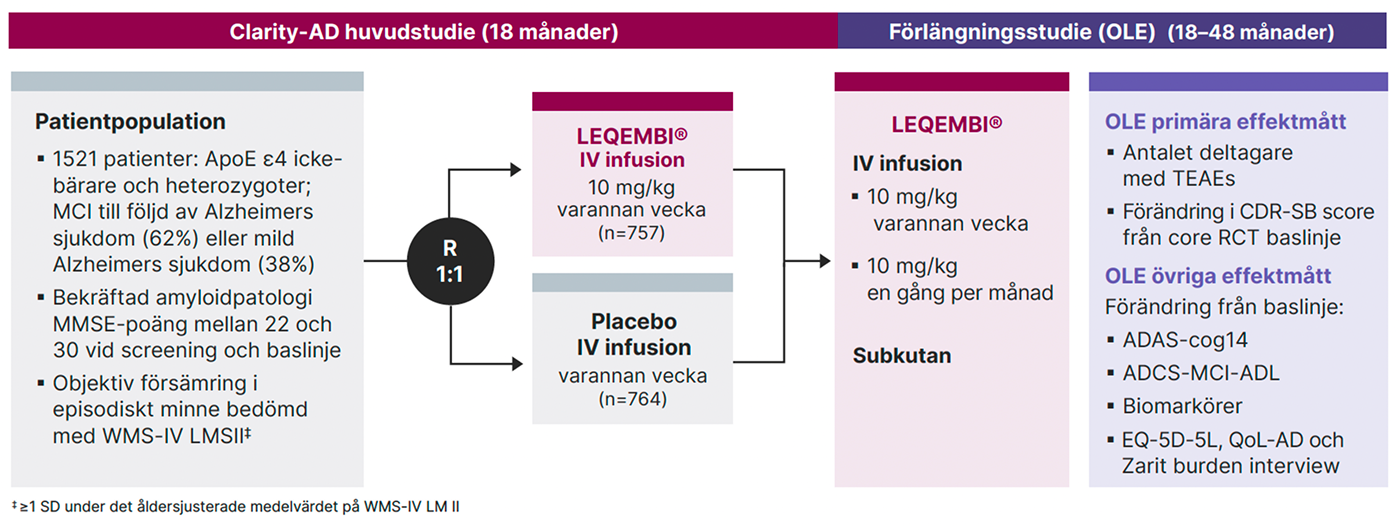
Totalt 1795 patienter randomiserades initialt till att få antingen LEQEMBI (n=898) eller placebo (n=897) i Clarity-AD, varav 1521 patienter var ApoE ε4-icke-bärare eller heterozygota dvs den population som är indicerade LEQEMBI i EU.1-3
I förlängningsstudien jämförs sjukdomsprogressionen för patienter som får LEQEMBI behandling med naturalförloppet hos en matchad kohort från ADNI.3-4
Patienter som fick LEQEMBI stannade längre i ett mildare stadium av sjukdomen jämfört med obehandlade patienter3
Detta innebär att under en tidsperiod på 4 år så inbromsades försämringen hos de patienter som behandlades med LEQEMBI 9.8 månader jämfört med de i den obehandlade ADNI-kohorten. Denna jämförelse illustreras i figur 1.3
För en patient i ett tidigt sjukdomsstadium där patienten endast har lindriga symtom, kan det betyda att man förlänger tiden det tar innan symptomen får en betydande påverkan på det dagliga livet. Det kan innebära att patienten kommer ihåg uppgifter och fortfarande klarar sin vardag utan hjälp från andra.
Fortsatt behandling med LEQEMBI förlänger tiden innan sjukdomen progredierar till nästa sjukdomsstadium3
En responderanalys utvärderade sjukdomsprogression genom att undersöka tiden till försämring mätt med CDR-SB vid 48 månader. Progression definierades som att poängen på CDR-SB utvecklades från MCI (0.5–4.0) till mild demens (4.5–9,0) eller mild demens till måttlig demens (9.5–15.5). Efter 4 år var andelen patienter som progredierat till ett värre sjukdomsstadium lägre i gruppen som behandlats med LEQEMBI.3
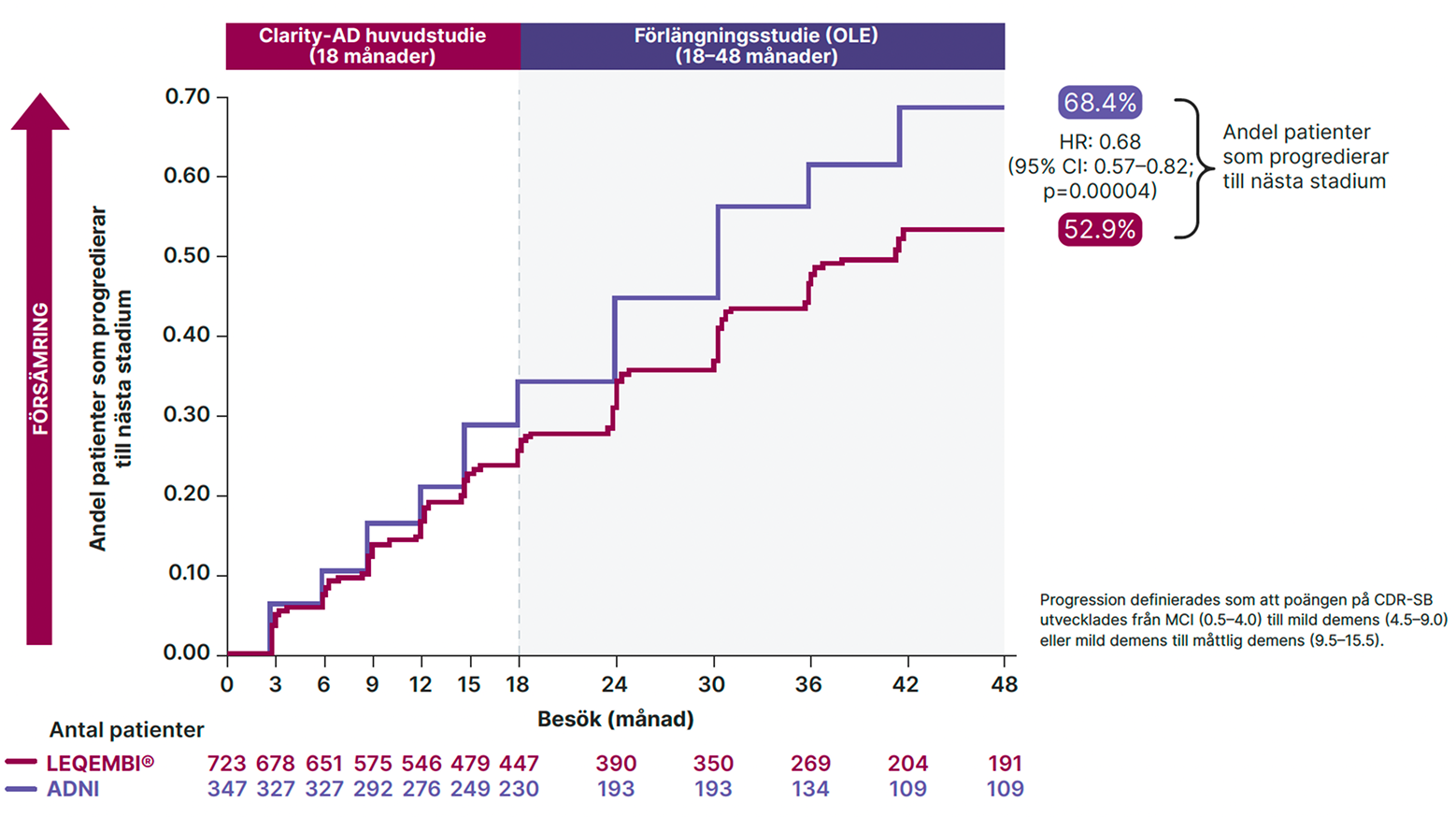
Figur 2. Skillnad i sjukdomsprogression under 4 år definierat som att poängen på CDR-SB utvecklades från MCI (0.5–4.0) till mild demens (4.5–9,0) eller mild demens till måttlig demens (9.5–15.5) ; Clarity-AD huvudstudie och förlängningsstudie jämfört med ADNI-kohorten. 2,3
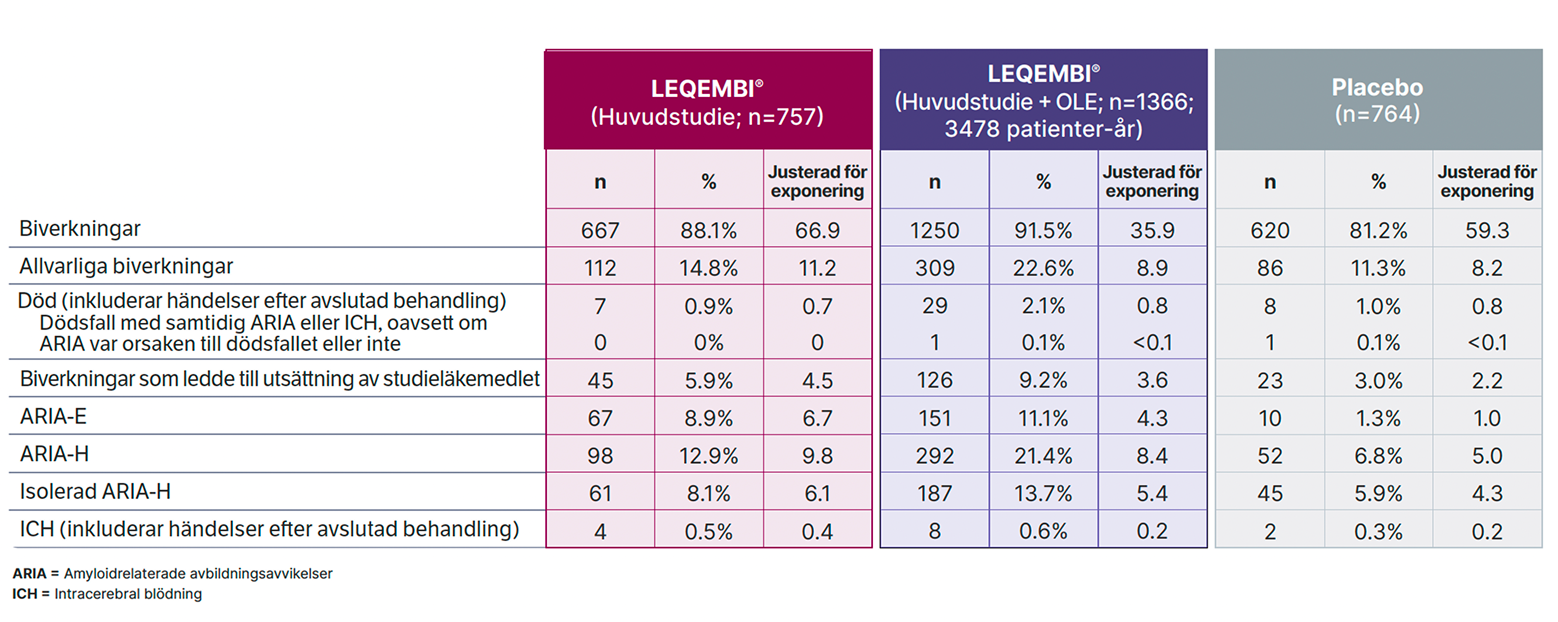
Biverkningar associerade med LEQEMBI blir generellt färre över tid med behandling och inga nya säkerhetsfynd har observerats hos patienter som behandlats under 4 år 1,3
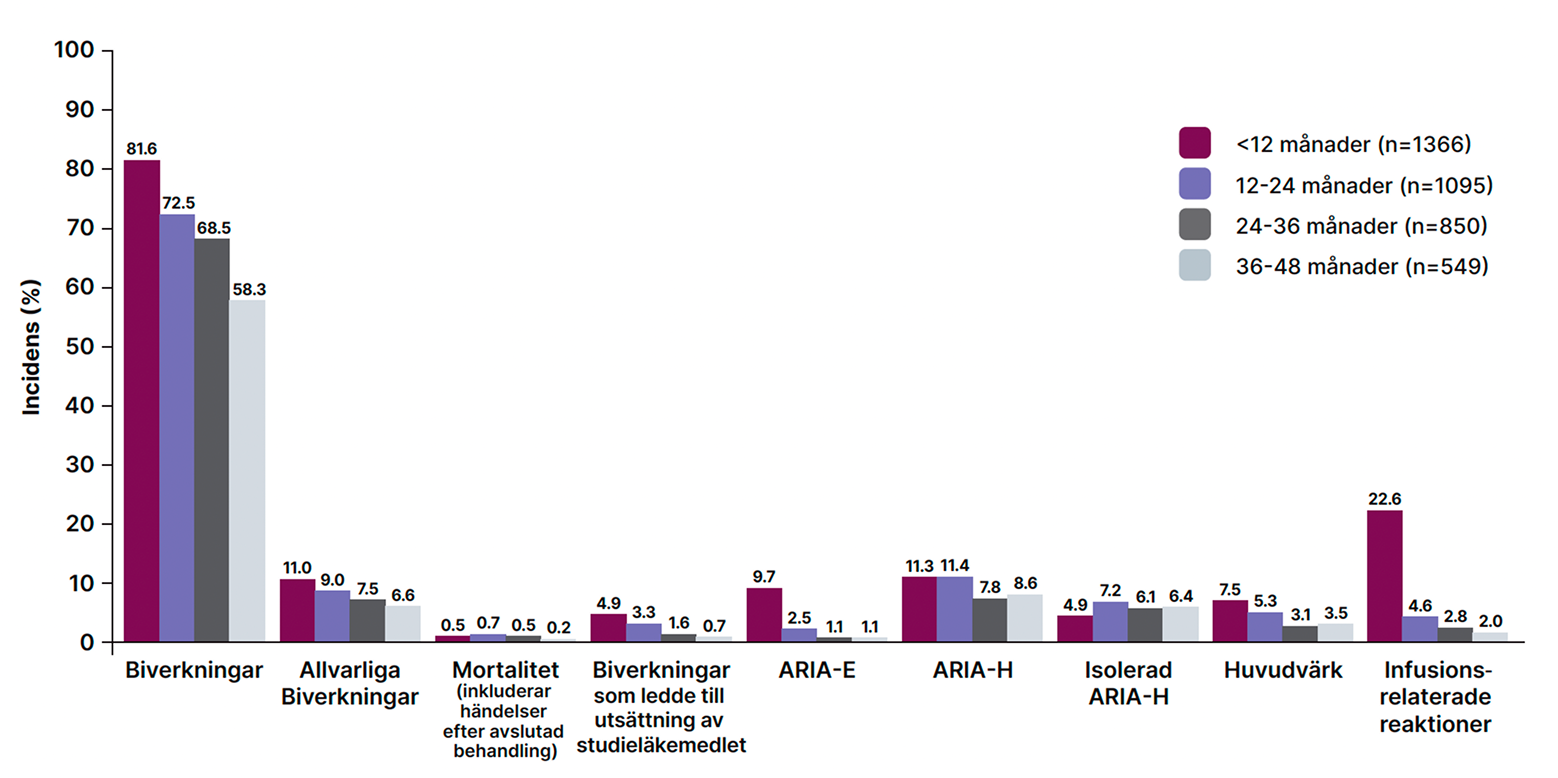
Figur 3. Förekomst av biverkningar och ARIA registrerade med 12 månaders intervall; CLARITY-AD huvudstudie och förlängningsstudie1,3
Biverkningsdata inkluderar 1366 patienter som behandlades med LEQEMBI i både Clarity-AD huvudstudie och förlängningsstudie (data cut-off 31 mars 2025). Den genomsnittliga exponeringen för LEQEMBI var 2,5 år med över 280 patienter som fått LEQEMBI i 4 år.3
Vid 48 månader hade 91,5 % av patienterna som fått LEQEMBI (n = 1250) rapporterat minst en biverkning, varav 88,1 % av patienterna hade rapporterat en biverkning redan under de första 18 månaderna. Detta indikerar att biverkningarna inträffar tidigt under behandlingen och förekomsten av ytterligare biverkningar är lägre under perioden 18–48 månader än de första 18 månaderna. Även allvarliga biverkningar är generellt mindre frekventa vid längre behandlingstid, och inga signaler observerades för ökad risk för dödsfall mellan placebo (0,8 %) och LEQEMBI (0,7 %) i huvudstudien, eller vid fortsatt LEQEMBI-behandling vid 48 månader (0,8 %) i förlängningsstudien.
En sammanfattning av biverkningar och ARIA utifrån behandlingstid med LEQEMBI återfinns i tabell 1.
Clarity-AD är en 18 månader lång dubbelblind, placebokontrollerad, multicenterstudie, för att bekräfta effekt och säkerhet med lecanemab (10 mg/kg givet intravenöst varannan vecka) jämfört med placebo hos patienter (N = 1795) med tidig Alzheimers sjukdom (AD), det vill säga mild kognitiv nedsättning (MCI) eller mild demens på grund av AD, med bekräftat ökad amyloidinlagring vid PET-undersökning eller i cerebrospinalvätskan 1,2
CDR-SB, Clinical Dementia Rating – Sum of Boxes; OLE, open label extension; SD, Standardavvikelse; ADNI, Alzheimer’s Disease Neuroimaging Initiative; ARIA-E, amyloid related imaging abnormalities with oedema; ARIA-H, amyloid related imaging abnormalities with haemosiderin deposition; ICH, Intracerebral blödning
Referenser
1. Leqembi (lecanemab) Produktresumé
2. Van Dyck CH et al. Lecanemab in Early Alzheimer’s Disease. NEJM 2023; 388:9-21. https://www.nejm.org/doi/10.1056/NEJMoa2212948.
3. Froelich, L., et al. A 48-Month Analysis of the Lecanemab Clarity AD Open-Label Extension in the ApoE ε4 Non-carriers or Heterozygotes Early Alzheimer’s Disease Population. Presented at the Congress of the German Society of Neurology (DGN), 2025.
4. ADNI Alzheimer’s Disease Neuroimaging Initiative. https://adni.loni.usc.edu/about/ [Accessed on 11th November 2025].






