Arktiska mutationen och Aβ-protofibriller
Professor Lars Lannfelts upptäckt av den arktiska mutationen påvisade de lösliga Aβ-protofibrillernas roll i utvecklingen av Alzheimers sjukdom.¹
Genetisk evidens utgör grunden för amyloidkaskadhypotesen. Mutationer i amyloidprekursorproteinet (APP) samt i presenilin 1 och 2 (PSEN1 och PSEN2), som ingår i γ-sekretaskomplexet, kan öka produktion eller aggregering av Aβ42. Dessa mutationer orsakar den autosomalt dominanta, familjära varianten av Alzheimers sjukdom (ADAD), vilken står för mindre än 1 % av alla Alzheimers-fall.2,3 Hundratals sådana mutationer har beskrivits,4 däribland framstående exempel som den svenska APP-mutationen (KM670/671NL) och den arktiska APP-mutationen (E693G).1
Den arktiska mutationen, som identifierades 2001 av professor Lars Lannfelt, ligger inom APP-genen som kodar för Aβ, och påträffades i en svensk familj med tidigt debuterande Alzheimers. Till skillnad från andra ADAD-mutationer ökar inte den arktiska APP-mutationen den totala produktionen av Aβ. Istället ökar det benägenheten för Aβ-peptider att aggregeras till lösliga protofibriller5-8. Trots denna ökade aggregeringstendens har studier visat minskade nivåer av Aβ40 och Aβ42 i konditionerat medium från celler som uttrycker den arktiska APP-mutationen samt i plasma hos mutationsbärare. Denna minskning förklaras av att mutationen främjar bildning av protofibriller som binder Aβ till aggregerade former.
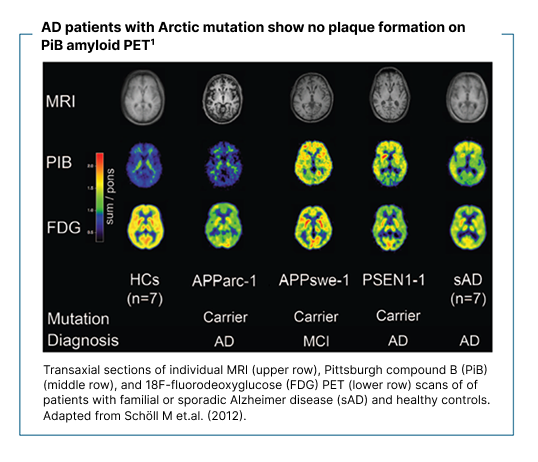
Neuropatologiska studier har visat att den arktiska APP-mutationen leder till utbredd Aβ-inlagring i hjärnan. In vivo-avbildning med Aβ-positronemissionstomografi (PET) har däremot visat avsaknad av typisk fibrillär Aβ-plackpatologi hos bärare och patienter med mutationen, trots kliniska och biomarkörprofiler förenliga med Alzheimers sjukdom.9-11
Lösliga Aβ-protofibriller kan initiera nedströms tau-patologi
Aβ-protofibriller kan initiera nedströms hyperfosforylering av tau-protein och aggregation av detta inuti neuronerna i form av neurofibrillnystan och dystrofiska neuriter.12-14 Ett viktigt behandlingsmål är att stoppa spridningen av tau-patologi.
Referenser
1. Nilsberth C, et al. The Arctic APP mutation (E693G) causes Alzheimer’s disease by enhanced Aβ protofibril formation. Nat Neurosci. 2001 Sep;4(9):887–93. doi:10.1038/nn0901-887
2. Goate A, et al. Segregation of a missense mutation in the amyloid precursor protein gene with familial Alzheimer’s disease. Nature. 1991 Feb 21;349(6311):704–6. doi:10.1038/349704a0
3. Sherrington R, et al. Cloning of a gene bearing missense mutations in early-onset familial Alzheimer’s disease. Nature. 1995 Jun 29;375(6534):754–60. doi:10.1038/375754a0
4. Weggen S, et al. Molecular consequences of amyloid precursor protein and presenilin mutations causing autosomal-dominant Alzheimer’s disease. Alzheimers Res Ther. 2012 Mar 28;4(2):9. doi:10.1186/alzrt107
5. Viola KL, et al. Amyloid β oligomers in Alzheimer’s disease pathogenesis, treatment, and diagnosis. Acta Neuropathol. 2015 Feb;129(2):183–206. doi:10.1007/s00401-015-1386-3
6. Johansson A, et al. Physiochemical characterization of the Alzheimer’s disease-related peptides Aβ1-42Arctic and Aβ1-42wt. FEBS J. 2006 Jun;273(12):2618–30. doi:10.1111/j.1742-4658.2006.05272.x
7. Päiviö A, et al. Unique physicochemical profile of β-amyloid peptide variant Aβ1-40E22G protofibrils: conceivable neuropathogen in Arctic mutant carriers. J Mol Biol. 2004 Jun 4;339(1):145–59. doi:10.1016/j.jmb.2004.03.004
8. Whitfield JF, et al. Alzheimer’s disease and its possible evolutionary origin: hypothesis. Cells. 2023 Jun;12(12):1618. doi:10.3390/cells12121618
9. Schöll M, et al. Low PiB PET retention in presence of pathologic CSF biomarkers in Arctic APP mutation carriers. Neurology. 2012 Jul 17;79(3):229–36. doi:10.1212/WNL.0b013e31825fdf18
10. Kalimo H, et al. The Arctic AβPP mutation leads to Alzheimer’s disease pathology with highly variable topographic deposition of differentially truncated Aβ. Acta Neuropathol Commun. 2013 May 10;1:60. doi:10.1186/2051-5960-1-60
11. Basun H, et al. Clinical and neuropathological features of the Arctic APP gene mutation causing early-onset Alzheimer disease. Arch Neurol. 2008 Jan;65(4):499. doi:10.1001/archneur.65.4.499
12. Hampel H, et al. The amyloid-β pathway in Alzheimer’s disease. Mol Psychiatry. 2021 Oct;26(10):5481–5503. doi:10.1038/s41380-021-01249-0
13. He Z, et al. Amyloid-β oligomers impair hippocampal long-term potentiation by disrupting glutamatergic neurotransmission. Nat Med. 2018 Jan;24(1):29–38. doi:10.1038/nm.4440
14. Lewis J, et al. Enhanced neurofibrillary degeneration in transgenic mice expressing mutant tau and APP. Science. 2001 Aug 24;293(5534):1487–91. doi:10.1126/science.1058189






