Vad är en klinisk relevant effekt vid en sjukdomsmodifierande behandling?
Vad är en klinisk relevant effekt vid en sjukdomsmodifierande behandling?
Betydelsefull vinst vid behandling av Alzheimers sjukdom
För att utvärdera meningsfull behandlingsvinst av Alzheimers sjukdom är det avgörande att väga in sjukdomens olika stadier. Det räcker inte att enbart jämföra statistiska p-värden mellan behandlings- och placebogruppen i kliniska studier. Istället behöver man utvärdera vilka mått som användes och omfattningen av skillnaden mellan grupperna över tid för att få en tydligare bild av behandlingens nytta.1
Sjukdomsstadier vid Alzheimers sjukdom och val av utfallsmått
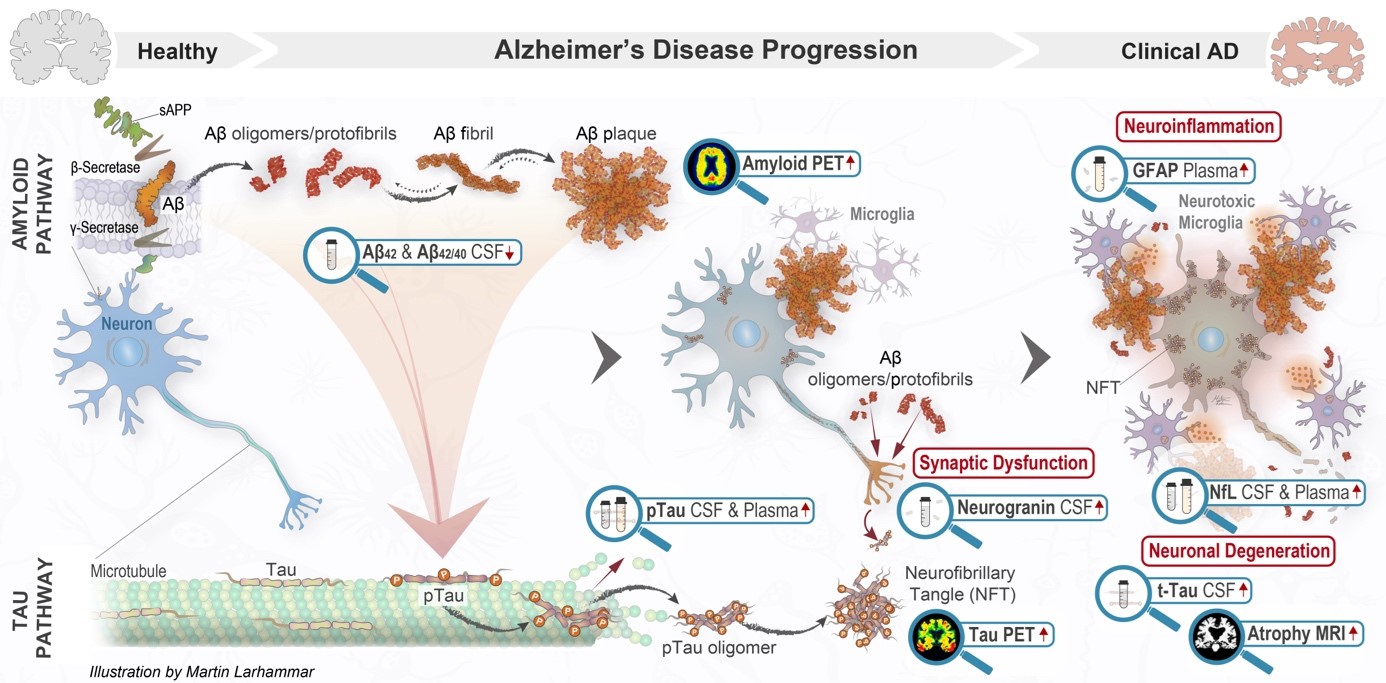
Alzheimers sjukdom påverkar olika regioner i hjärnan där symtombilden varierar beroende på vilket sjukdomsstadie patienten befinner sig i. National Institute of Aging-Alzheimer’s Association (NIA-AA) klassificerar dessa stadier från 0-6 som speglar det kliniska sjukdomsförloppet; från preklinisk Alzheimer med biomarkörer utan symtom, till MCI (mild cognitive impairment) och slutligen demens (mild, måttlig och svår), (se figur).1,2
I de tidiga stadierna av sjukdomen kan meningsfull nytta endast mätas med biomarkörer eftersom det ännu inte finns några symtom av sjukdomen, medan funktionella och kognitiva utfall är relevanta i de senare stadierna. Det är därför viktigt att välja utfallsmått som är relevanta för det specifika sjukdomsstadiet vid utvärdering av behandlingens nytta.1
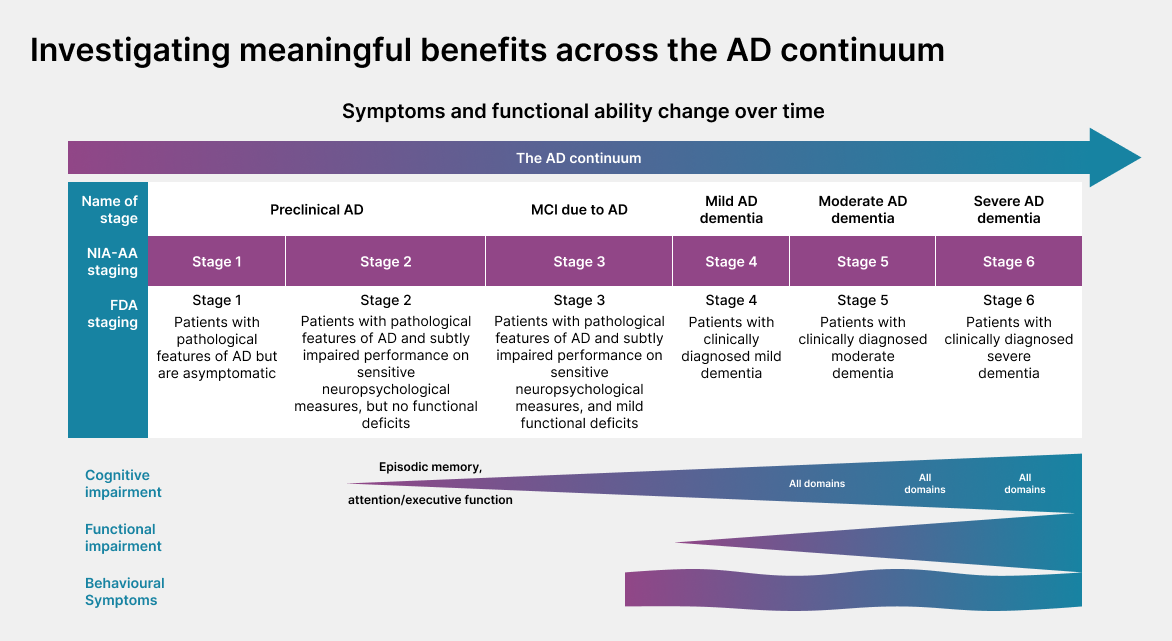
AD, Alzheimer’s disease; ADL, activities of daily living; FDA, Food and Drug Administration; MCI, mild cognitive impairment; MMSE, Mini-Mental State Examination; NIA-AA, National Institute of Aging–Alzheimer’s Association. Figure adapted from Cohen S, et al. J Prev Alzheimers Dis. 2022;9:507–522.
I kliniska prövningar används olika bedömningsskalor för att mäta kognition, funktion och beteende. Dessa fångar kritiska utfall som fördröjning i försämring av minnesförmåga, ADL (Activities of Daily Living), vårdgivarens börda, självständighet och livskvalitet där resultatet av skattningarna återspeglar nyttan av studieläkemedlet.3,4
Tester för att mäta kognitiva och funktionella utfall
Vanliga tester som används för att mäta kognitiva utfall är ADAS-Cog och MMSE medan ADCS-ADL, A-IADL-Q och FAQ används för att utvärdera funktion i vardagen.1,5-7 CDR-SB (Clinical Dementia Rating-Sum of Boxes) är en skattningsskala med 18 skalsteg som används för att mäta både kognitiv förmåga och funktion (se tabell).8,9 Denna skala används ofta i anti-amyloidstudier, särskilt hos symtomatiska patienter.1
ADAS-Cog = Alzheimer’s Disease Assessment Scale – Cognitive Subscale
MMSE = Mini Mental State Examination
ADCS-ADL = Alzheimer’s Disease Cooperative Study – Activities of Daily Living
A-IADL-Q= Amsterdam Instrumental Activities of Daily Living Questionnaire
FAQ =Functional Activities Questionnaire
Clinical Dementia Rating (CDR)
| 0 | 0.5 | 1 | 2 | 3 |
|---|
| CDR sum of boxes range2 | 0.5-2.5 | 3.0-4.0 | 4.5-9.0 | 9.5-15.5 | 16.0-18.0 |
|---|---|---|---|---|---|
| Staging category2 | Questionable impairment | Very mild dementia | Mild dementia | Moderate dementia | Severe dementia |
| Score only as decline from previous usual level due to cognitive loss, not impairment due to other factors | |||||
| I M P A I R M E N T1 | |||||
|---|---|---|---|---|---|
| None (0) | Questionable (0.5) | Mild (1) | Moderate (2) | Severe (3) | |
| Memory | No memory loss or slight inconsistent forgetfulness | Consistent slight forgetfulness; partial recollection of events; “benign” forgetfulness | Moderate memory loss; more marked for recent events; defect interferes with everyday activities | Severe memory loss; only highly learned material retained; new material rapidly lost | Severe memory loss; only fragments remain |
| Orientation | Fully oriented | Fully oriented except for slight difficulty with time relationships | Moderate difficulty with time relationships; oriented for place at examination; may have geographical disorientation elsewhere | Severe difficulty with time relationships; usually disoriented to time, often to place | Oriented to person only |
| Judgment & problem solving | Solves everyday problems & handles business & financial affairs well; judgment good in relation to past performance | Slight impairment in solving problems, similarities, and differences | Moderate difficulty in handling problems, similarities, and differences; social judgment usually maintained | Severely impaired in handling problems, similarities, and differences; social judgment usually impaired | Unable to make judgments or solve problems |
| Community affairs | Independent function at usual level in job, shopping, volunteer & social groups | Slight impairment in these activities | Unable to function independently at these activities although may still be engaged in some; appears normal to casual inspection | No pretence of independent function outside home | |
| Appears well enough to be taken to functions outside a family home | Appears too ill to be taken to functions outside a family home | ||||
| Home and hobbies | Life at home, hobbies, and intellectual interests well maintained | Life at home, hobbies, and intellectual interests slightly impaired | Mild but definite impairment of function at home; more difficult chores abandoned; more complicated hobbies and interests abandoned | Only simple chores preserved; very restricted interests, poorly maintained | No significant function in home |
| Personal care | Fully capable of self-care | Needs prompting | Requires assistance in dressing, hygiene, keeping of personal effects | Requires much help with personal care; frequent incontinence | |
1. Morris JS, Neurology 1993; 43:2412-2414; 2. O´Bryant, et al. Arch Neurol. 2008;65:1091-1096
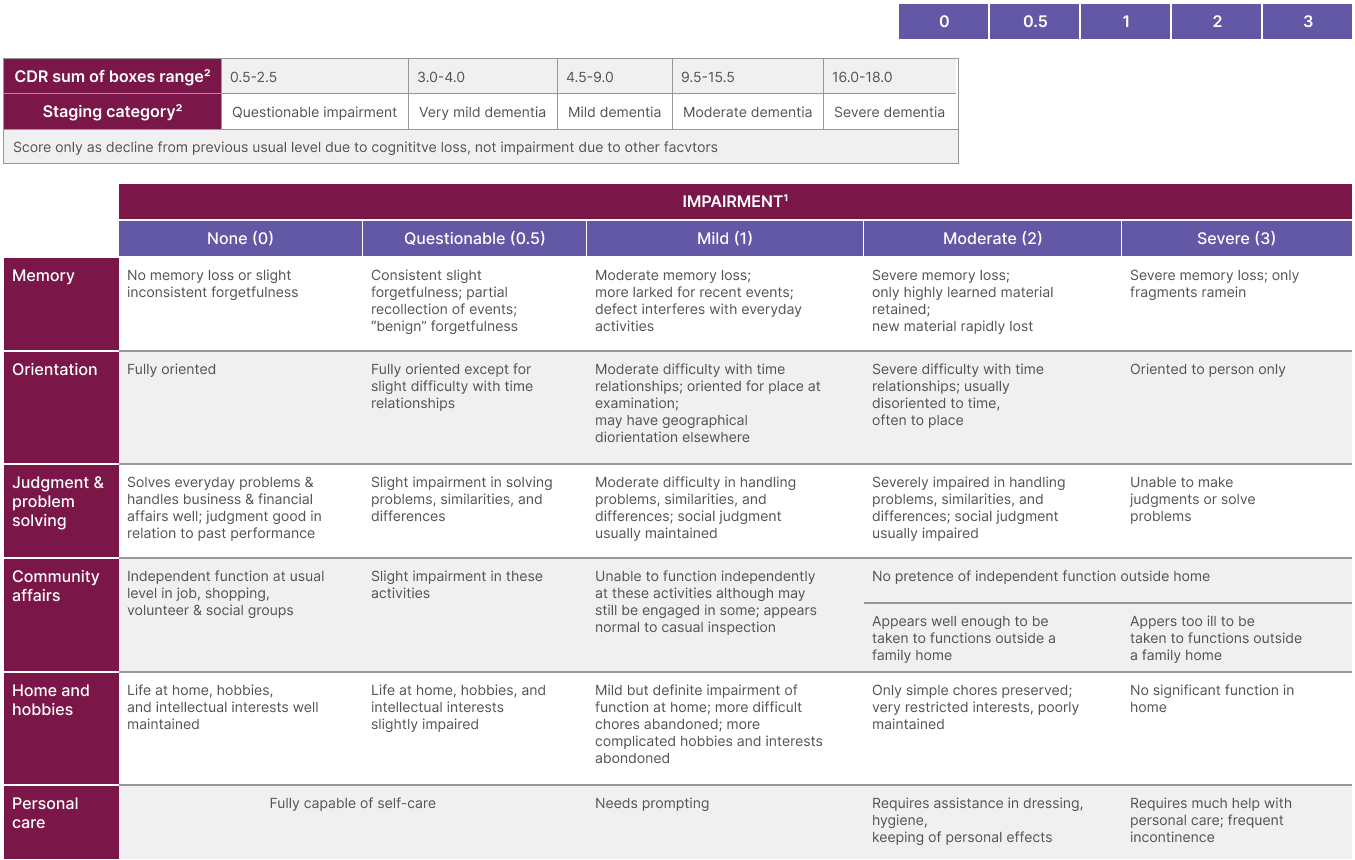
En skillnad på 0,5 på CDR-SB skalan kan innebära att en patient som tidigare inte haft några symtom, eller endast mycket subtila, nu upplever betydande symtom som påverkar det dagliga livet. Det kan innebära att behöva skriva anteckningar för att komma ihåg uppgifter, eller övergå från att vara självständig till att behöva hjälp.8
Skalan utvecklades ursprungligen för att utvärdera personer i demensstadiet och blir mer känslig i takt med att sjukdomen fortskrider från MCI till demens, där poängen ackumuleras och ökar snabbt. Vid preklinisk Alzheimer (stadie 2) skattas inga poäng på skalan, medan patienter i MCI-fasen (stadie 3) kan skattas till mellan 0,5 och 2,5 poäng. Att kommunicera en skillnad på CDR-SB-skalan vid en specifik tidpunkt är oftast mindre meningsfullt vid sjukdomsmodifierande behandlingar, då nyttan förväntas öka över tid.8,21
Skillnad mellan symtomlindrande och sjukdomsmodifierande behandling
Symtomatisk behandling ger en tillfällig nytta som kan förbättra ADL eller kognitiv funktion så länge man tar läkemedlet, men behandlingen bromsar inte sjukdomens progression. Effekten kan dessutom minska över tid, särskilt vid svår demens. Detta beror på att sjukdomen fortsätter att utvecklas och påverkar hjärnan, vilket gör att denna typ av behandling blir mindre effektiv i att lindra symtomen vartefter som sjukdomen fortskrider.
Sjukdomsmodifierande behandling däremot riktar sig mot den underliggande orsaken till sjukdomen och bromsar långsiktigt sjukdomens progression med effekt på kognition och funktion. Därför är det viktigt med tidig behandlingsstart och att behandlingen ges kontinuerligt. Vid sjukdomsmodifierande behandling bör effekten gradvis öka över tid. Detta fångas bäst av termer som ”ihållande sjukdomsfördröjning” eftersom det beskriver effekten över hela sjukdomsförloppet, inte bara en liten del.10-12
Sett från kliniska studier avseende anti-amyloidbehandling minskar mängden amyloid-β-plack i hjärnan och även påverkan på nedströmsmekanismer har observerats, som förändringar i tau, vilka är nära kopplade till kliniska symtom och sjukdomsprogression.13,14
Kliniska studier och smalt tidsfönster
Kliniska studier ger en begränsad bild av sjukdomens progression eftersom de ofta bara täcker en liten del av sjukdomsförloppet. Prekliniska studier speglar bara några år av hela den prekliniska fasen, som vanligtvis är längre än ett decennium, ibland kanske till och med två decennier. Detta gäller även för pågående kliniska studier som speglar senare stadier av sjukdomen (se figur).1,15,16
Trial design and disease stage
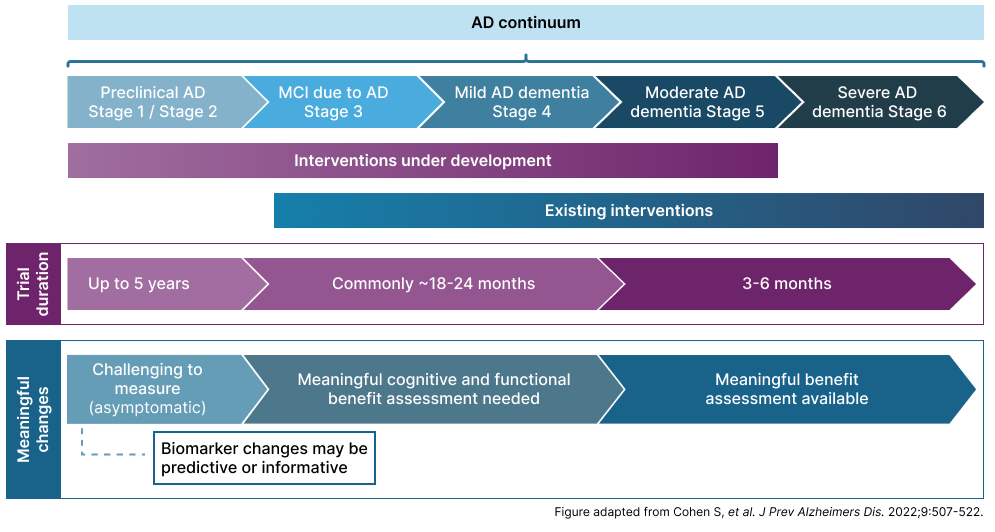
AD, Alzheimer’s disease; MCI, mild cognitive impairment. 1. Cohen S,et al. J Prev Alzheimers Dis.2022;9:507-522; 2. Porsteinsson AP, et al. J Prev Alzheimers Dis. 2021;3:371-386;3. Cummings J, et al. Alz res Therapy. 2019;11:76.
Definition av betydelsefull vinst vid sjukdomsmodifierande behandling
Experter sammankallade via Alzheimer’s Association och kliniska översikter1,2,10,12 har konstaterat att meningsfull nytta vid sjukdomsmodifierande behandling av Alzheimers sjukdom kan definieras genom följande fem kriterier:
långsammare sjukdomsprogression
ökning av skillnaden mellan behandlings- och placebogrupp
ökad tid till händelse (sparad tid till progression)
förändringar i biomarkörer som förutsäger framtida klinisk nytta
resultaten bör uppnås med en fördelaktig risk-nytta-profil
Medan farmakologiska effekter av symtomatisk behandling kan observeras inom timmar eller dagar, förväntas effekten av sjukdomsmodifierande behandlingar öka över tid.
Eftersom de sjukdomsmodifierande effekterna kanske inte framträder tydligt under korta kliniska prövningar, kan långsiktiga (läkemedel-placebo-skillnader) uppskattas med hjälp av statistiska modeller för sjukdomsprogression och behandlingssvar.
En viktig aspekt av sjukdomsmodifierande behandlingar är förmågan att försena progressionen till ett visst sjukdomsstadie. För patienten är det relevant att prata om vunnen tid tills demensstadiet, som många fruktar mest. Den extra tid som patienten kan klara av dagliga aktiviteter utan omfattande hemtjänst eller fördröjning av flytt till ett vårdhem.3
Referenser
1. Cohen S, et al. Meaningful cognitive and functional benefit assessment in Alzheimer’s disease. J Prev Alzheimers Dis. 2022;9(3):507–22.
2. Petersen RC, et al. Expectations and clinical meaningfulness of randomized controlled trials. Alzheimers Dement. 2023;19(6):2730–6.
3. Cummings J, et al. The role of clinical trials in understanding Alzheimer’s disease. J Prev Alzheimers Dis. 2017;4(2):109–15.
4. Tochel C, et al. What outcomes are important to patients with mild cognitive impairment or Alzheimer’s disease, their caregivers, and health-care professionals? A systematic review. Alzheimers Dement Diagn Assess Dis Monit. 2019;11(1):231–47.
5. Kueper JK, et al. The Alzheimer’s Disease Assessment Scale-Cognitive Subscale (ADAS-Cog): modifications and responsiveness in pre-dementia populations. J Alzheimers Dis. 2018;63(2):423–44.
6. Galasko D, et al. An inventory to assess activities of daily living for clinical trials in Alzheimer’s disease. Alzheimer Dis Assoc Disord. 1997;11(Suppl 2):S33–9.
7. Nosheny RL, et al. The Alzheimer’s Disease Neuroimaging Initiative: key findings and lessons learned. JAMA Netw Open. 2023;6(9):e2333786.
8. Morris JC. The Clinical Dementia Rating (CDR): current version and scoring rules. Neurology. 1993;43(11):2412–4.
9. O’Bryant SE, et al. Staging dementia using Clinical Dementia Rating Scale sum of boxes scores: a Texas Alzheimer’s Research Consortium study. Arch Neurol. 2008;65(8):1091–5.
10. Cummings J, et al. Defining disease modifying therapy for Alzheimer’s disease. J Prev Alzheimers Dis. 2017;4(2):109–15.
11. Atri A. Alzheimer’s disease clinical trials: changing paradigms in the treatment of AD. Semin Neurol. 2019;39(2):227–40.
12. Assunção SS, et al. Current perspectives on disease modifying therapies for Alzheimer’s disease. Alzheimers Res Ther. 2022;14(1):54.
13. Jack CR Jr, et al. NIA-AA research framework: toward a biological definition of Alzheimer’s disease. Alzheimers Dement. 2018;14(4):535–62.
14. Jack CR Jr, et al. Disease pathology across Alzheimer’s disease continuum. Nat Med. 2024 Jun 27. Epub ahead of print.
15. Porsteinsson AP, et al. Diagnosis of early Alzheimer’s disease: clinical practice in 2021. J Prev Alzheimers Dis. 2021;8(3):371–86.
16. Cummings J, et al. The “rights” of precision drug development for Alzheimer’s disease. Alzheimers Res Ther. 2019;11:76.
17. Eisai Co., Ltd. LEQEMBI (lecanemab) product information [Internet]. [citerad 2025 aug 27]. Tillgänglig från: https://www.ema.europa.eu/en/medicines/human/EPAR/leqembi
18. Klunk WE, et al. Imaging brain amyloid in Alzheimer’s disease with Pittsburgh Compound-B. Ann Neurol. 2004;55(3):306–19.
19. Mohs RC, et al. Development of cognitive instruments for use in clinical trials of antidementia drugs: additions to the Alzheimer’s Disease Assessment Scale that broaden its scope. Alzheimer Dis Assoc Disord. 1997;11(Suppl 2):S13–21.
20. Wang J, et al. ADCOMS: a composite clinical outcome for prodromal Alzheimer’s disease trials. J Neurol Neurosurg Psychiatry. 2016;87(9):993–9.
21. Cummings J, et al. Meaningful benefit and minimal clinically important difference (MCID) in Alzheimer’s disease: open peer commentary. Alzheimers Dement (N Y). 2023;9:e12411.