Patologin bakom Alzheimers sjukdom
Patologin vid Alzheimers sjukdom börjar utvecklas flera decennier innan de första symtomen uppstår. Ju tidigare man får diagnosen, desto större möjlighet finns det att bromsa degenerationen och bibehålla hjärnans funktion.1-5
Patologin vid Alzheimers sjukdom börjar utvecklas många år före klinisk debut av sjukdomen. När symtomen på kognitiv störning blir märkbara har betydande förlust av synapser och celler redan skett.1-5 Därför är det viktigt att identifiera och diagnostisera patienter med lindrig kognitiv störning (MCI, Mild Cognitive Impairment) eller lindrig Alzheimers sjukdom, eftersom de kan ha nytta av en tidig intervention med en monoklonal amyloid-β (Aβ)-antikropp, till exempel LEQEMBI®.
Alzheimers sjukdom är en obeveklig neurodegenerativ sjukdom som orsakas av en kontinuerlig bakomliggande process som börjar före och fortsätter efter inlagring av amyloid-β-plack.1-5
Patologin vid Alzheimers sjukdom antas initieras av dysmetabolism av amyloid-β (Aβ)-peptider. Den ledande hypotesen om utvecklingen av patologin vid Alzheimers sjukdom slår fast att Alzheimers sjukdom orsakas av dysmetabolism av Aβ-peptider, vilket leder till en uppbyggnad av Aβ i hjärnan och utlöser följdeffekter nedströms, som tau-patologi, ökad oxidativ stress och inflammation, synapsförlust och neuronal degeneration.6,7
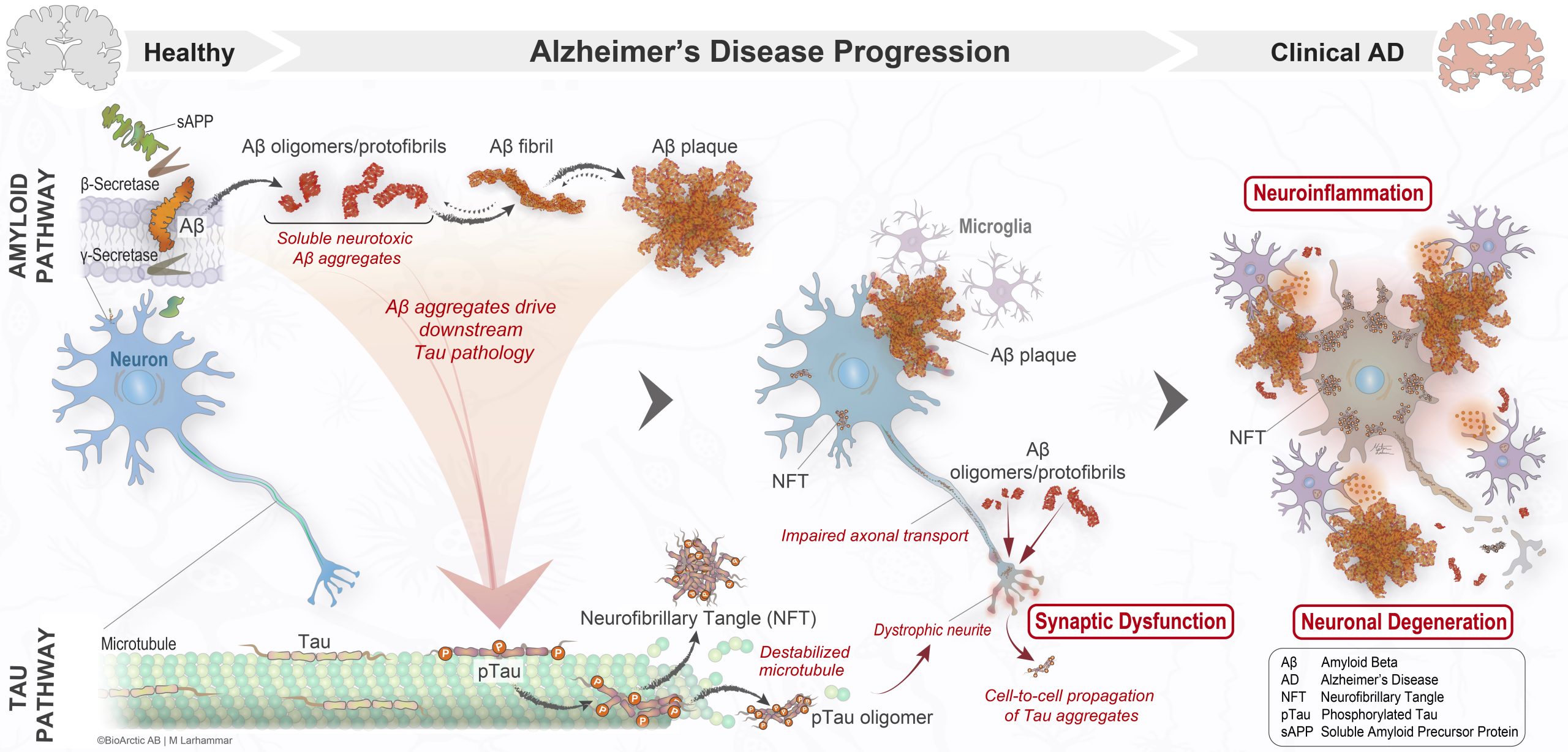
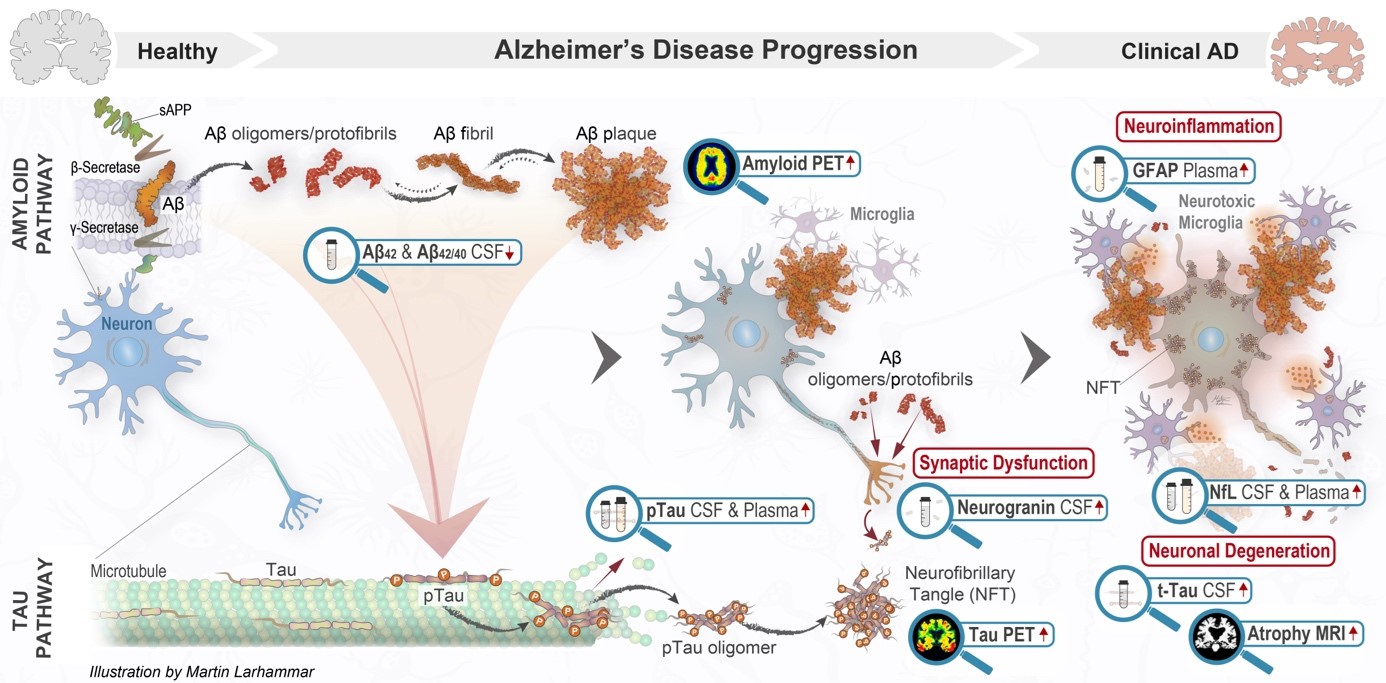
Figur 1. Patogenes för Alzheimers sjukdom. Illustrationen visar en schematisk översikt över patologin vid Alzheimers sjukdom från friskt tillstånd till kliniskt detekterbar Alzheimers, med fokus på två viktiga ömsesidigt beroende patologiska vägar, amyloidvägen och tau-vägen. Amyloidvägen börjar med klyvning av lösligt amyloidprekursorprotein (sAPP) med hjälp av β-sekretas och γ-sekretas, vilket leder till att Aβ-peptid bildas. Aβ bildar lösliga neurotoxiska aggregat som fortskrider från små oligomerer till större lösliga protofibriller, olösliga fibriller och så småningom Aβ-plack (det patologiska kännetecknet för Alzheimers sjukdom). Aβ-aggregat driver på nedströms tau-patologi, däribland hyperfosforylering av tau (pTau), vilket leder till destabilisering av mikrotubuli och försämrad axonal transport. När pTau aggregeras börjar det ackumuleras intracellulärt som neurofibrillnystan (NFT). Tau-aggregat tros kunna sprida sig från ett område i hjärnan till ett annat, sannolikt från cell till cell på ett liknande sätt som prioner. Aβ-oligomerer och protofibriller stör den neuronala funktionen, vilket leder till synaptisk dysfunktion. En kritisk komponent i sjukdomsprogressionen är aktivering av mikroglia, som leder till försämrad fysiologisk mikrogliafunktion och neuroinflammation. Aβ- och tau-patologi i samband med olöst neuroinflammation försämrar så småningom den synaptiska dysfunktionen och orsakar den synapsförlust och neurodegeneration som ligger bakom den kliniska presentationen av Alzheimers sjukdom.
Referenser: Serrano-Pozo A, et al. Plaque-associated local toxicity increases over the clinical course of Alzheimer disease. Am J Pathol. 2016 Feb;186(2):375–84. doi:10.1016/j.ajpath.2015.10.010 Paranjape GS, et al. Isolated amyloid-β(1–42) protofibrils, but not isolated fibrils, are robust stimulators of microglia. ACS Chem Neurosci. 2012 Apr 18;3(4):302–11. doi:10.1021/cn2001106 Jucker M, et al. Alzheimer’s disease: from immunotherapy to immunoprevention. Cell. 2023 Oct 12;186(21):4260–70. doi:10.1016/j.cell.2023.09.018 Tolar M, et al. The path forward in Alzheimer’s disease therapeutics: reevaluating the amyloid cascade hypothesis. Alzheimers Dement. 2020 Nov;16(11):1553–60. doi:10.1016/j.jalz.2019.09.075
Amyloidkaskadhypotesen
Amyloidkaskadhypotesen, som ursprungligen föreslogs av Hardy och Higgins (1992)6, innebär att ackumulering av amyloid-β (Aβ)-peptider, särskilt Aβ42-isoformen, är den patologiska händelse som initierar Alzheimers sjukdom. Detta har sedan dess varit den centrala hypotesen för patologin vid Alzheimers sjukdom och har legat till grund för utvecklingen av både diagnostiska och terapeutiska metoder.
Enligt den ursprungliga beskrivningen utlöser ackumulering av Aβ-peptid och inlagring i form av extracellulära amyloidplack en kaskad av händelser som innefattar följande:1
Bildning av neurofibrillnystan (NFT, Neurofibrillary tangles) av hyperfosforylerat tau-protein
Förlust av integritet och tilltagande dysfunktion hos synapserna
Neuroinflammation
Neuronförlust
Kognitiv störning
Aβ-tau-interaktion: en mekanistisk länk
Amyloidkaskadhypotesen omfattar nu en tvåstegsmodell, där Aβ-patologin initierar kaskaden medan tau-patologin sprider och förstärker neurodegenerationen.
Några av de möjliga bakomliggande mekanismerna är:
Aβ-oligomerer som inducerar tau-hyperfosforylering via aktivering av kinaser som GSK 3β, CDK5 och MAPK. 13
Fellokaliserat fosforylerat tau lossnar från mikrotubuli, destabiliserar cytoskelettet och försämrar den axonala transporten.14
Hyperfosforylerat tau aggregeras till neurofibrillnystan (NFT) som korrelerar närmare med kognitiv störning än plack.15
Aβ-inducerad tau-patologi som sprider sig transsynaptiskt på ett liknande sätt som prioner, sannolikt genom exosommedierade eller receptormedierade mekanismer.16
Experimentmodeller visar att minskning av Aβ kan dämpa tau-patologin, men tau-patologin ensam är tillräcklig för att driva neurodegeneration, vilket understryker den synergistiska toxiciteten hos Aβ och tau.
Även om merparten av data om tau-spridning från cell till cell kommer från in vitro– och in vivo-modeller har de tydliga spatiotemporala mönstren på senare tid kunnat förklaras in vivo hos människor med hjälp av bilddiagnostik som funktionell magnetresonanstomografi (fMRI) och tau-PET.17
Inflammationens och mikroglia-aktiveringens roll
Aβ-ackumulering aktiverar mikroglia och astrocyter och initierar ett kroniskt, olöst inflammatoriskt svar som förvärrar tau-patologin. Cytokiner som TNF-α, IL-1β och ROS kan i sin tur ytterligare främja tau-fosforylering och neuronal stress.18
Detta skapar en ond cirkel:
Aβ utlöser inflammation → inflammationen främjar tau-patologi → tau-patologin förvärrar neurodegenerationen och sprider sig.
Alzheimers sjukdom-patologibörda uttömmer rensningsmekanismerna hos mikroglia.19
Alzheimers sjukdom är en kronisk sjukdom. Den ökade amyloid-β-uppbyggnaden är kontinuerlig under hela sjukdomsprogressionen och fortsätter att utlösa nedströms patologi, vilket orsakar nedbrytning av synapser och neuronal degeneration. Alzheimers patientens hjärna befinner sig i ett sårbart tillstånd och varje kvarstående synaps är viktig. Det som finns kvar behöver skyddas.20
En reviderad amyloidkaskadhypotes föreslår:
Aβ-patologi är en tidig och nödvändig, men inte tillräcklig, utlösare.
Lösliga Aβ-former, inte plack, är de primära drivkrafterna för toxicitet.
Aβ verkar uppströms från tau och inflammation, men när tau-patologin väl är etablerad blir den självspridande och kliniskt dominerande.
Tidiga insatser riktade mot Aβ, särskilt oligomerer och protofibriller, påverkar nedströms tau-patologi och bromsar försämring av kognitiva symtom.
Senare insatser riktade mot Aβ, kan visa sig bli mindre effektiva på grund irreversibel tau-medierad skada och neuroinflammatorisk priming.
Kliniska prövningar med monoklonala anti-Aβ-antikroppar, däribland LEQEMBI, stöder denna modell.
LEQEMBI binder företrädesvis till lösliga aggregat av Aβ14,15 och uppvisar rensning av plack och bromsning av försämring av kognitiva symtom när behandlingen inleds tidigt.
Referenser
1. Hampel H, et al. The amyloid-β pathway in Alzheimer’s disease. Mol Psychiatry. 2021 Oct;26(10):5481–5503. doi:10.1038/s41380-021-01249-0
2. Kumar A, et al. Alzheimer disease. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Aug 11 [citerad 2025 aug 20]. Tillgänglig från: https://www.ncbi.nlm.nih.gov/books/NBK499922/
3. Cummings J, et al. Alzheimer’s disease diagnostic criteria: practical applications. Alzheimers Res Ther. 2012 Sep 5;4(5):35. doi:10.1186/alzrt138
4. Jack CR, et al. NIA-AA Research Framework: toward a biological definition of Alzheimer’s disease. Alzheimers Dement. 2018 May;14(4):535–62. doi:10.1016/j.jalz.2018.02.018
5. Bateman RJ, et al. Clinical and biomarker changes in dominantly inherited Alzheimer’s disease. N Engl J Med. 2012 Aug 9;367(9):795–804. doi:10.1056/NEJMoa1202753
6. Hardy J, et al. Alzheimer’s disease: the amyloid cascade hypothesis. Science. 1992 Apr 10;256(5054):184–5. doi:10.1126/science.1566067
7. Selkoe DJ, et al. The amyloid hypothesis of Alzheimer’s disease at 25 years. EMBO Mol Med. 2016 Jun;8(6):595–608. doi:10.15252/emmm.201606210
8. Hong W, et al. Diffusible, highly bioactive oligomers represent a critical species in Alzheimer’s disease pathogenesis. Acta Neuropathol. 2018 Jul;136(1):19–40. doi:10.1007/s00401-018-1846-3
9. Shankar GM, et al. Amyloid-β protein dimers isolated from Alzheimer’s brains impair synaptic structure and function. Nat Med. 2008 Aug;14(8):837–42. doi:10.1038/nm1782
10. Walsh DM, et al. Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature. 2002 Apr 4;416(6880):535–9. doi:10.1038/416535a
11. Hartley DM, et al. Protofibrillar intermediates of amyloid β-protein induce acute electrophysiological changes and progressive neurotoxicity in cortical neurons. J Neurosci. 1999 Oct 15;19(20):8876–84. doi:10.1523/JNEUROSCI.19-20-08876.1999
12. Sehlin D, et al. Large aggregates are the major soluble Aβ species in AD brain fractionated with density gradient ultracentrifugation. PLoS One. 2012 Feb 15;7(2):e32014. doi:10.1371/journal.pone.0032014
13. Pooler AM, et al. Propagation of tau pathology in Alzheimer’s disease: identification of novel therapeutic targets. Alzheimers Res Ther. 2013 May 29;5(4):49. doi:10.1186/alzrt203
14. Tapia-Rojas C, et al. Mislocalized phosphorylated tau detaches from microtubules, destabilizes the cytoskeleton and impairs axonal transport. Alzheimers Dement. 2019 Feb;15(2):226–40. doi:10.1016/j.jalz.2018.08.006
15. Guillozet AL, et al. Neurofibrillary tangles, not senile plaques, parallel duration and severity of Alzheimer’s disease. Acta Neuropathol. 2003 Feb;105(2):148–53. doi:10.1007/s00401-002-0620-6
16. de Calignon A, et al. Propagation of tau pathology in a model of early Alzheimer’s disease. Neuron. 2012 Feb 23;73(4):685–97. doi:10.1016/j.neuron.2011.11.033
17. Lewis J, et al. Enhanced neurofibrillary degeneration in transgenic mice expressing mutant tau and APP. Science. 2001 Aug 24;293(5534):1487–91. doi:10.1126/science.1058189
18. Heneka MT, et al. Neuroinflammation in Alzheimer’s disease. Lancet Neurol. 2015 Apr;14(4):388–405. doi:10.1016/S1474-4422(15)70016-5
19. Streit WJ, et al. Dystrophic microglia in late-onset Alzheimer’s disease. Glia. 2020 Apr;68(4):845–54. doi:10.1002/glia.23782
20. McDade E, et al. Lecanemab in patients with early Alzheimer’s disease: detailed results of a randomized, double-blind, placebo-controlled, phase 3 trial. Alzheimers Res Ther. 2022;14:191. doi:10.1186/s13195-022-01033-9
Upptäck mer
03.