Aβ-syntes
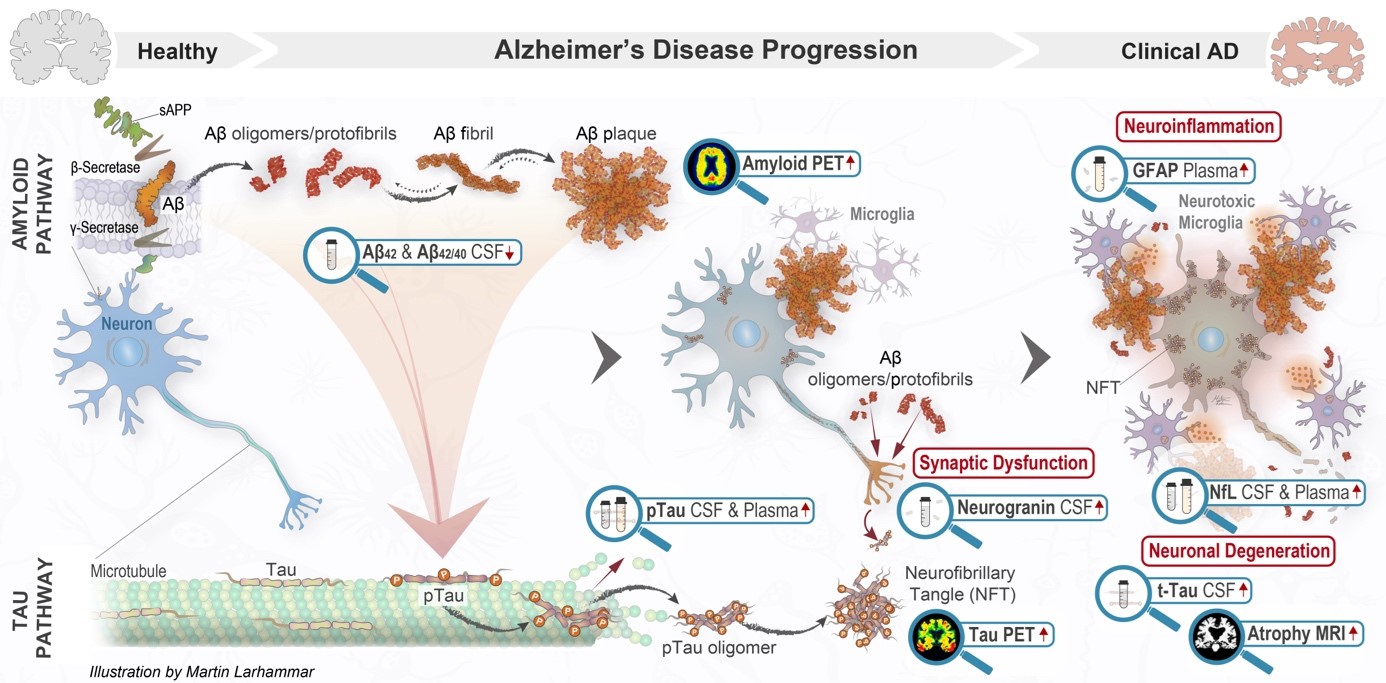
Aβ-peptider är nyckelkomponenter i amyloidplack och även i en annan patologi som förknippas med Alzheimers sjukdom nämligen cerebral amyloid angiopati (CAA). De genereras genom proteolytisk klyvning av det membranbundna amyloidprekursorproteinet (APP) med hjälp av enzymerna β-sekretas och γ-sekretas. Klyvning med hjälp av β-sekretas sker utanför Aβ-regionen, vilket ger ett lösligt fragment (sAPPβ) och ett membranbundet fragment (C99). C99-fragmentet klyvs ytterligare med hjälp av γ-sekretas, vilket frigör Aβ-peptider som sträcker sig från 1–37 till 1–42 i längd. Lösliga monomera former, som produceras fysiologiskt av de flesta mänskliga celler, varierar i längd från 39 till 43 aminosyror.
De vanligaste varianterna av Aβ är dock Aβ40 och Aβ42, varav Aβ40 är den mest rikligt förekommande formen i cerebrospinalvätska (CSV) och blodplasma. Även om Aβ42 är mindre rikligt förekommande utgör denna variant den viktigaste komponenten i amyloidplack, på grund av dess högre tendens att aggregeras. Även om Aβ40 är mindre benägen att aggregeras jämfört med Aβ42 bidrar den väsentligt till Alzheimers sjukdom-patologin, särskilt i vaskulära amyloidinlagringar som fibriller vid CAA, som huvudsakligen består av Aβ40.1
Aβ-plackbildningen vid Alzheimers är morfologiskt mycket varierande, och proportionerna av Aβ42 och Aβ40 skiljer sig avsevärt.2
Referens för illustration:3 Johannesson, M. et al. Lecanemab demonstrates highly selective binding to Aβ protofibrils isolated from Alzheimer’s disease brains. Mol. Cell. Neurosci. 130, 103949 (2024).
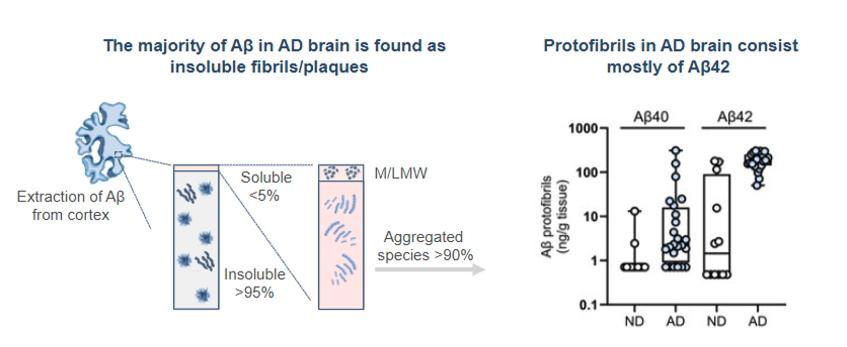
Figur 2. Olika Aβ-former i en hjärna med Alzheimers sjukdom. Vänster: Fördelning av Aβ-arter i en hjärna med Alzheimers sjukdom. I hjärnparenkymet är över 95% av Aβ olösliga fibriller/plack, och mindre än 5% finns i löslig form (monomerer, oligomerer och protofibriller). Inom den lösliga fraktionen består mer än 90 % av lösliga aggregerade arter som oligomerer och protofibriller, vilket innebär att endast en liten del utgörs av Aβ-monomerer. Höger: Peptidsammansättning i protofibriller extraherade från temporala cortex i en hjärna med Alzheimers sjukdom. Protofibrillerna består huvudsakligen av den mer aggregeringsbenägna peptiden Aβ42. Dessutom är förekomsten av Aβ42-protofibriller signifikant högre hos Alzheimers patienter jämfört med icke-dementa individer (ND). Förekomsten av Aβ40 i protofibrillerna är lägre och visar mindre skillnad mellan Alzheimers och ND. Opublicerad illustration
Lösliga Aβ-aggregat – utlösare för neurodegeneration1
Lösliga Aβ-arter: Med tiden klarlades en viktig begränsning hos den ursprungliga amyloidkaskadhypotesen: plackbördan korrelerar inte väl med försämring av kognitiva symtom.4,5 Detta ledde till justeringar av begreppen för att betona rollen hos lösliga Aβ-oligomerer och protofibriller som de viktigaste neurotoxiska arterna, snarare än olösliga plack.
Dessa små, spridbara Aβ-aggregat kan:1
störa synaptisk överföring
störa långsiktig potentiering (LTP)
utlösa tau-hyperfosforylering
aktivera mikroglia och astrocyter, vilket leder till kronisk neuroinflammation
Referenser
1.Hampel H, et al. The amyloid-β pathway in Alzheimer’s disease. Mol Psychiatry. 2021 Oct;26(10):5481–5503. doi:10.1038/s41380-021-01249-0
2. Koutarapu S, et al. Chemical imaging delineates Aβ plaque polymorphism across the Alzheimer’s disease spectrum. Nat Commun. 2025;16:3889. doi:10.1038/s41467-025-39233-4
3. Johannesson M, et al. Lecanemab demonstrates highly selective binding to Aβ protofibrils isolated from Alzheimer’s disease brains. Mol Cell Neurosci. 2024;130:103949. doi:10.1016/j.mcn.2024.103949
4. Arriagada P, et al. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimer’s disease. Neurobiol Aging. 1992 Jul-Aug;13(4):393–8. doi:10.1016/0197-4580(92)90111-F
5. Ingelsson M, et al. Early Aβ accumulation and progressive synaptic loss, gliosis, and tangle formation in Alzheimer’s disease brain. Neurology. 2004 Mar 23;62(6):925–31. doi:10.1212/01.WNL.0000115110.00686.3C