*31% mindre försämring av kognitiva symtom och funktioner under 18 månader hos lecanemab-behandlade patienter jämfört med placebogruppen (genomsnittlig förändring från baslinjen enligt CDR-SB 1,22 jämfört med 1,75; gruppskillnad −0,535; 95% KI −0,778; −0,293).
ADMINISTRERING AV LEQEMBI OCH INFORMATION VID BEHANDLING
Kliniskt utvärderad dosering varannan vecka för att uppnå optimal effekt
Full dos från dag 1, ingen titrering behövs
Monitorering för ARIA: Genomför en MR av hjärnan tidigast 6 månader innan behandling med LEQEMBI inleds för att utvärdera om det finns befintlig ARIA. Därefter ska tre MR undersökningar utföras under de första 28 veckorna av behandlingen
För mer information om ARIA

DOSERING, ADMINISTRERING OCH MONITORERING AV BEHANDLING MED LEQEMBI
LEQEMBI administreras som en intravenös infusion under cirka 1 timme en gång varannan vecka. Vid den första infusionen ska patienten observeras i cirka 2,5 timmar efter avslutad infusion med avseende på tecken och symtom på infusionsrelaterade reaktioner.
LEQEMBI ska spädas ut före intravenös infusion.
Om en infusion missas ska nästa dos administreras så snart som möjligt.
Den rekommenderade dosen av LEQEMBI är 10 mg/kg kroppsvikt administrerat som en intravenös (i.v.) infusion en gång varannan vecka.
Under behandling med LEQEMBI bör testning av kognitiv funktion och klinisk bedömning av symtom ske ungefär var 6:e månad. De kognitiva testerna och utveckling av symtom bör användas för att bedöma om patienten har progredierat till måttlig Alzheimers sjukdom och/eller om det kliniska förloppet i övrigt tyder på att LEQEMBI inte har visat effekt hos patienten, och ge underlag för ett beslut huruvida behandlingen med LEQEMBI ska avslutas.
Behandlingen med LEQEMBI ska avslutas när patienten progredierar till måttlig Alzheimers sjukdom.
Behandlingen ska inledas och övervakas av läkare med erfarenhet av diagnostik och behandling av Alzheimers sjukdom och med snabb tillgång till magnetresonanstomografi (MR). Infusioner av LEQEMBI ska administreras av kvalificerad sjukvårdspersonal som utbildats för att övervaka, känna igen och hantera infusionsrelaterade reaktioner.
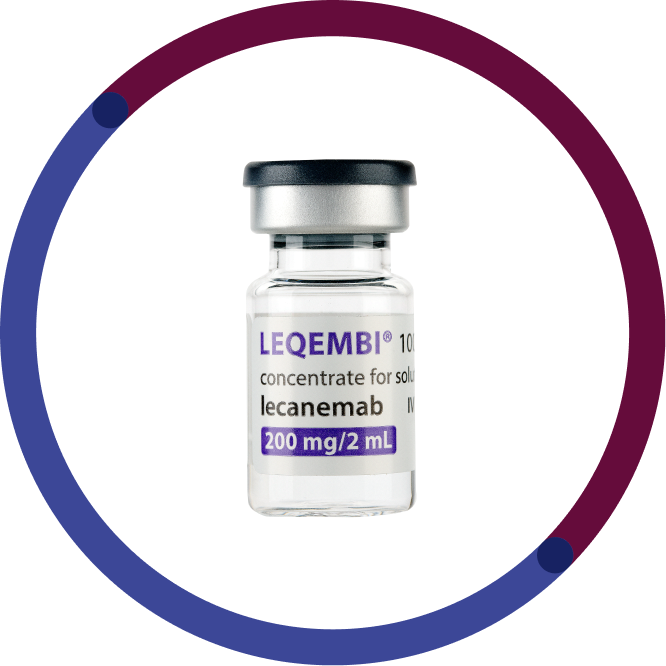
En 2 ml vial innehåller 200 mg lecanemab (200mg/ml)
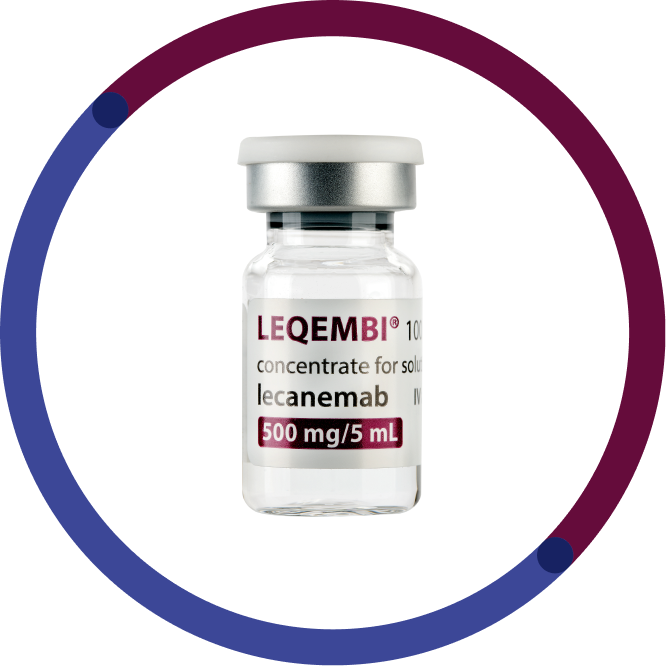
En 5 ml vial innehåller 500 mg lecanemab (500mg/5ml)
PRAKTISK HANTERING – FÖRBERED OCH HANTERA LEQEMBI
Parenterala läkemedel ska kontrolleras visuellt avseende partiklar och missfärgning före administrering. Om endera observeras ska läkemedlet kasseras.
Beredning av infusionslösning
Beräkna dosen, den totala volymen lösning med LEQEMBI som krävs och antalet injektionsflaskor som behövs baserat på patientens faktiska kroppsvikt. Varje injektionsflaska innehåller en koncentration av LEQEMBI på 100 mg/ml.
Dra ut erforderlig volym LEQEMBI från injektionsflaskan/injektionsflaskorna och tillsätt till 250 ml 9 mg/ml (0,9%) natriumkloridlösning för injektion.
Vänd försiktigt på infusionspåsen som innehåller den spädda lösningen med LEQEMBI så att den blandas helt. Skaka inte påsen.
Infusionspåsar tillverkade av polypropen, polyvinylklorid, samextruderad polyolefin/polyamid eller eten/propen-sampolymer har bekräftats vara kompatibla för administrering av LEQEMBI.
Efter spädning rekommenderas omedelbar användning.
Hållbarhet
Kemisk och fysikalisk stabilitet vid användning har påvisats i 24 timmar vid 25°C. Ur mikrobiologisk synvinkel bör produkten användas omedelbart, såvida inte spädningsmetoden utesluter risk för mikrobiell kontaminering. Om inte produkten används omedelbart är det användaren som ansvarar för förvaringstider och förvaringsförhållanden före användningen.
Administrering av infusionslösning
Låt den spädda lösningen med LEQEMBI värmas till rumstemperatur före infusionen.
Administrera hela volymen LEQEMBI intravenöst under cirka 1 timme genom en intravenös slang som innehåller ett terminalt lågproteinbindande inline-filter på 0,2 mikrometer (kompatibla filtermaterial inkluderar polytetrafluoreten, polyetersulfon, polykarbonat, polyvinylidendifluorid, polypropen, polyuretan och polysulfon). Spola infusionsslangen för att säkerställa att allt LEQEMBI administreras.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Referenser
LEQEMBI Produktresumé