

*31% mindre försämring av kognitiva symtom och funktioner under 18 månader hos lecanemab-behandlade patienter jämfört med placebogruppen (genomsnittlig förändring från baslinjen enligt CDR-SB 1,22 jämfört med 1,75; gruppskillnad −0,535; 95% KI −0,778; −0,293).
SÄKERHETEN FÖR LEQEMBI® HAR UTVÄRDERATS HOS 2 203 PATIENTER I KLINISKA PRÖVNINGAR OCH BEKRÄFTATS HOS >30 000 PATIENTER1 BEHANDLADE I KLINISK VÅRD
LEQEMBI visade följande resultat i den indicerade populationen (vuxna patienter med klinisk diagnos av lindrig kognitiv störning och mild demens på grund av Alzheimers sjukdom (tidig Alzheimers sjukdom) som är icke-bärare eller homozygota bärare av apolipoprotein E ε4 (ApoE ε4) med bekräftad amyloidpatologi).
2% (16/757) av patienterna upplevde symtomatisk ARIA-E eller ARIA-H
Mindre än 9% förekomst av ARIA-E, varav 1,6% symtomatisk
Ingen ökad mortalitet i behandlingsgruppen jämfört med placebo (0,8% för LEQEMBI och 0,9% för placebo)
Behandlingsavbrott på grund av biverkningar hos 7% i LEQEMBI-gruppen jämfört med 3% i placebogruppen
Merparten av de radiologiska händelserna relaterade till ARIA-E förekom tidigt i behandlingen (inom de första 7 doserna) och var mestadels lindriga (4%, n= 31/757) respektive måttliga (4%, n=33/757).
Risken för ARIA-relaterade radiologiska händelser, inklusive symtomatiska och allvarliga sådana, är förhöjd hos homozygota bärare av apolipoprotein E ε4 (ApoE ε4), jämfört med heterozygota bärare och icke-bärare. LEQEMBI är därför inte indicerat för användning hos patienter som är homozygota bärare av ApoE ɛ4.

SAMMANFATTNING AV SÄKERHETSPROFIL
Säkerheten för LEQEMBI har utvärderats hos 2 203 patienter som fått minst en dos av LEQEMBI. De vanligaste biverkningarna hos den indicerade populationen var infusionsrelaterade reaktioner (26%), ARIA-H (13%), huvudvärk (11 %) och ARIA-E (8,9%). Krampanfall inklusive status epilepticus har rapporterats vid behandling med LEQEMBI i kliniska prövningar.
De flesta infusionsrelaterade reaktionerna inträffade vid den första infusionen (75%, 178/237) och allvarlighetsgraden var mestadels lindrig (69%) eller måttlig (28%).
ARIA kan uppträda spontant hos patienter med Alzheimer’s sjukdom. Behandling med LEQEMBI kan orsaka ARIA, antingen i form av ARIA med ödem (ARIA-E) som kan observeras på MR som hjärnödem eller ödem i sulci, eller ARIA med hemosiderinutfällning (ARIA-H), som inkluderar mikroblödning och superficiell sideros.
ARIA-H och ARIA-E kan förekomma tillsammans. Det förelåg ingen ökning av isolerad ARIA-H (dvs. ARIA-H hos patienter som inte också fick ARIA-E) för LEQEMBI jämfört med placebo.
Inklusive asymtomatiska radiologiska händelser observerades ARIA (ARIA-E och ARIA-H) hos 17% (128/757) av patienterna som fick LEQEMBI jämfört med 7% (55/764) av patienterna som fick placebo i studie 301 (indicerad population).
Symtomatisk ARIA förekom hos 2% (16/757) av patienterna som fick LEQEMBI, varav symtom som krävde sjukhusvistelse rapporterades hos 0,4% (3/757).
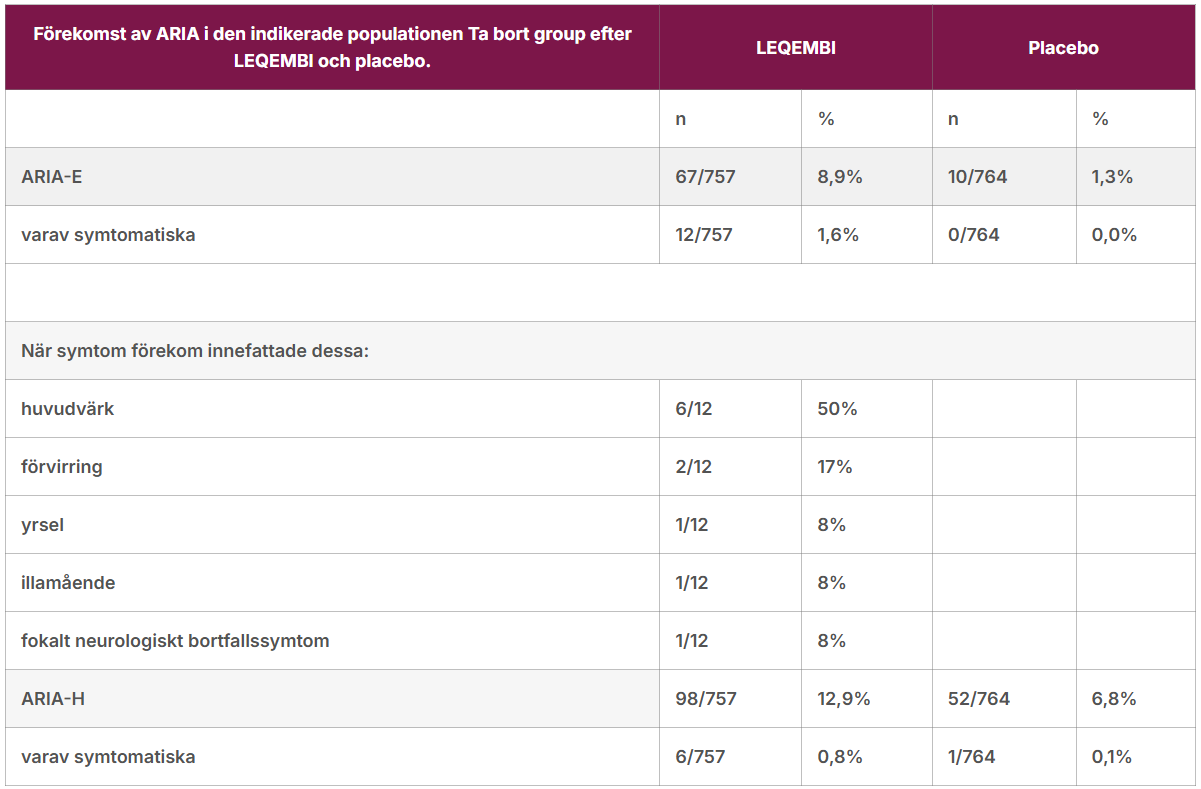
ARIA-E observerades hos 9% (67/757) av patienterna som fick LEQEMBI. Majoriteten av ARIA-E var asymtomatisk, medan symtomatisk ARIA-E rapporterades hos 2% (12/757) av patienterna. Symtom som rapporterades i samband med ARIA-E var huvudvärk (50%, 6/12), förvirring (17%, 2/12), yrsel (8%, 1/12) och illamående (8%, 1/12). Fokala neurologiska bortfall (8%, 1/12) förekom också.
Studie 301: CLARITY-AD, indicerad population
| Förekomst av ARIA i den indikerade populationen | LEQEMBI | Placebo | ||
|---|---|---|---|---|
| n | % | n | % | |
| ARIA-E | 67/757 | 8,9% | 10/764 | 1,3% |
| varav symtomatiska | 12/757 | 1,6% | 0/764 | 0,0% |
| . | ||||
| När symtom förekom innefattade dessa: | ||||
| huvudvärk | 6/12 | 50% | ||
| förvirring | 2/12 | 17% | ||
| yrsel | 1/12 | 8% | ||
| illamående | 1/12 | 8% | ||
| fokalt neurologiskt bortfallssymtom | 1/12 | 8% | ||
| ARIA-H | 98/757 | 12,9% | 52/764 | 6,8% |
| varav symtomatiska | 6/757 | 0,8% | 1/764 | 0,1% |
Försiktighet ska iakttas när man överväger användning av LEQEMBI hos patienter med riskfaktorer för intracerebral blödning. LEQEMBI ska inte sättas in hos patienter som får pågående behandling med antikoagulantia.
- Intracerebrala blödningar större än 1 cm i diameter rapporterades hos 0,5% (4/757) av patienterna i studie 301 efter behandling med LEQEMBI, jämfört med 0,1% (1/764) av patienterna som fick placebo. Fall av hjärnblödning med dödlig utgång har observerats hos patienter som fått LEQEMBI. Det fanns ingen ökad mortalitet i LEQEMBI-gruppen: 0,8% jämfört med 0,9% i placebogruppen
Det är viktigt att rapportera misstänkta biverkningar som uppstår vid klinisk användning. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket.
Mer information: Produktresumé för LEQEMBI (lecanemab)
ARIA-H = amyloidrelaterad radiologisk avvikelse mikroblödning och hemosiderinutfällning
ARIA-E = amyloidrelaterad radiologisk avvikelse – hjärnödem
Referenser
1. Data on file
2. LEQEMBI Produktresumé







